题目内容
1.2015年4月15日上午,扬州仪征市青山镇一家自来水厂发生氯气泄漏事故,附近两所学校及周围居民共千余人被紧急疏散,事故未造成人员伤亡.当人们逃离事故现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是( )| A. | NaOH | B. | Na2CO3 | C. | Ca(OH)2 | D. | NaCl |
分析 强碱具有腐蚀性,利用弱碱性溶液吸收氯气,由此分析解答.
解答 解:当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,水溶液能较易吸收氯气,但不能对人有腐蚀作用;
A.NaOH是强碱具有强腐蚀性,故A不选;
B.Na2CO3溶液水解显碱性,可以吸收氯气,腐蚀性较小,符合要求,故B选;
C.Ca(OH)2是强碱具有强腐蚀性,故C不选;
D.NaCl不能吸收氯气,故D不选;
故选B.
点评 本题考查氯气的性质,为高频考点,把握氯气碱的反应及尾气处理等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列变化需要加入氧化剂才能实现的是( )
| A. | NaOH→NaCl | B. | HCl→Cl2 | C. | H2SO4→H2 | D. | H2S→S |
12.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA | |
| B. | pH=1的稀硫酸中含有的H+数为0.1NA | |
| C. | 133g氯化铝分子中含有铝离子的个数为NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
9.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液
依然澄清,且溶液中阴离子种类与原溶液中种类相同.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)仅由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O=2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是D.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO 32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液
依然澄清,且溶液中阴离子种类与原溶液中种类相同.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)仅由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O=2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是D.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2来中和 | 化学法 |
16.化学家创造出一种物质“干水”,其每个颗粒含水95%,外层是SiO2,干水吸收二氧化碳的能力比普通清水高三倍.下列有关说法正确的是( )
| A. | 干水和干冰是同一种物质 | |
| B. | 干水是纯净物 | |
| C. | 用干水吸收CO2有助于减缓温室效应 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
6.已知某溶液中仅含有5种离子(不考虑水的电离和离子的水解),其含量均为1mol,它们可能是K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+、OH-、HCO3-、CO32-、Cl-、NO3-和SO42-中的5种.为确定该溶液中所含的离子,向该溶液中加入足量稀盐酸,有无色气体产生,且反应前后溶液中的阴离子种类没有变化.则下列说法正确的是( )
| A. | 原溶液中可能含有K+,一定没有HCO3-和OH-,将产生的无色气体通入澄清石灰水中,澄清石灰水变浑浊 | |
| B. | 原溶液中一定含有Cl-和NO3-,可能含有SO42-,反应生成的无色气体遇空气变红棕色 | |
| C. | 原溶液中所含的阳离子为Mg2+、Fe2+,加入稀盐酸所发生的反应为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 若向原溶液中加入过量NaOH溶液,将所得沉淀过滤、洗涤、灼烧到恒重,得到的固体质量为107 g |
13.下列实验操作中正确的是( )
| A. | 蒸馏时,当烧瓶中液体出现暴沸时,要立即添加碎瓷片 | |
| B. | 蒸发操作时,应使溶液蒸发至干,以保证得到的固体中没有任何水分 | |
| C. | 分液操作时,分液漏斗中下层液体先从下口放出,再让上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
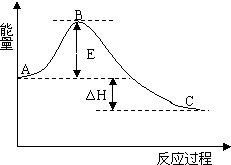 2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: