��Ŀ����
����Ŀ����������ʵ�����������ʵ�������ȷ���ǣ� ��
ʵ�� | ���� | ʵ����� | |
A | ��ij��Һ���ȵμ��������ᣬ�ٵμ�����BaCl2��Һ | ���ְ�ɫ���� | ԭ��Һ�к���SO42-��SO32-��HSO3-�е�һ�ֻ��� |
B | ����������ᷴӦ���ɵ����壬ͨ��һ��Ũ��Na2SiO3��Һ�� | ���ְ�ɫ��״���� | ���ԣ�HCl>H2CO3>H2SiO3 |
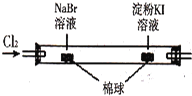
C |
| ��������Ϊ��ɫ���ұ������Ϊ��ɫ | �����ԣ�Cl2>Br2>I2 |
D | ��������Һ������Cu(OH)2����Һ��ϼ��� | ����ש��ɫ���� | �����Ƿ����к���ȩ�� |
A.AB.BC.CD.D
���𰸡�D
��������
A. �������ǿ�����ԣ��ȵμ������ữ��������SO32-��HSO3-����SO42-������ɫ����������ΪAgCl��ԭ��Һ���ܴ��������ӣ���A����
B. ��������ᷴӦ����CO2���壬�������������ӷ���CO2�����л����HCl���壬������ͨ��һ��Ũ��Na2SiO3��Һ��ʱ��HCl��Na2SiO3��Һ��Ӧ����H2SiO3��ɫ��״�����������֤��H2CO3��H2SiO3������ǿ������B����
C. ��������NaBr��KI��Ӧ�����ʵ�鲻�ܱȽ�Br2��I2�������ԣ���C����
D. ��������Һ������Cu(OH)2����Һ��ϼ��ȣ�����ש��ɫ�����������DZ�����������������Ӧ��֤�������Ǻ�CHO����D��ȷ��
��ѡD��

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�����Ŀ���Ķ��������Ϣ���ƶ�Ԫ�ؼ��й����ʣ���Ҫ��ش����ʣ�
��Ϣ����X��Y��Z��W�dz����Ķ�����Ԫ�أ���ԭ����������������ԭ�Ӻ���������������������2��
��1��������Ϣ����Xһ������_________������ţ�.
A���� | B��̼ | C���� | D���� |
��Ϣ������������Ԫ�صĵ��ʾ�����������������ȼ�գ����ɵ������������У�����������
��ϡ���ᣬ����������Ũ����������Һ�����������Է�������������26��
��2��������Ԫ�����Ƿ������һ������Ԫ�أ�_____________________________________��
��Ϣ��������������Ԫ�ص�����ɵĻ�����м�������������Һ�����岿���ܽ⣬���ˣ���
��Һ�м���������ռ���Һ��������Һ��������ɫ������
��3����ɫ������Ļ�ѧʽΪ____________________________________________________��
��Ϣ��������������Ԫ�ص�����ɵĻ�����м��������ռ���Һ�����岿���ܽ⣬���ˣ���
��Һ�м��������������Һ��������Һ��������ɫ������
��4�����ɰ�ɫ����������ӷ���ʽΪ____________________________________________��
��Ϣ����X��Wͬ����
��5��X��Ũ�������ʱ��Ӧ�Ļ�ѧ����ʽΪ_______________________________________��