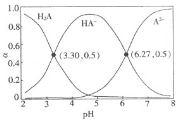
题目内容
【题目】某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成, 设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
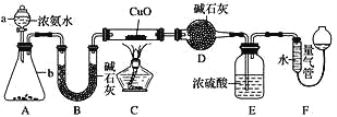
(1)仪器 a 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.Na2SO3 固体与浓 H2SO4
C.碳与浓 H2SO4 D.铜与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _________,表明 SO2 的氧化性比 I2___________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
④某硫酸厂拟用含 Cr2O72-的酸性废水处理烟气中 SO2,反应后的铬元素以 Cr3+形式存在, 则反应中氧化剂和还原剂的物质的量之比是 ______________。
【答案】分液漏斗 还原性 2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O 防止F中的水分进入D装置,并吸收未反应的氨气 调整F装置,使两边液面相平
3Cu + N2 + 3H2O 防止F中的水分进入D装置,并吸收未反应的氨气 调整F装置,使两边液面相平 ![]() B 无明显现象 弱 Na2SO3和NaHSO3 1:3
B 无明显现象 弱 Na2SO3和NaHSO3 1:3
【解析】
(1)~(5) 根据题意观察装置可知:A装置为氨气发生装置,B装置干燥氨气,C为反应装置,D装置吸收反应产生的水,E装置防止F中的水分进入D装置干扰实验结果,F装置测量生成氮气的体积。可在此基础上结合相关知识解(1)~(5)小题;
(6) ① A装置特点为固液不加热制取气体,根据各反应的条件和产物可对各选项作出判断;
② SO2不能和KI反应,无法将I-氧化为I2;
③ 将SO2通到NaOH溶液中,发生的反应为:2NaOH + SO2 = Na2SO3 + H2O,或NaOH + SO2 = NaHSO3,根据题给数据计算n(NaOH)和n(SO2)的比值,可判断反应的产物。
④ 氧化还原反应中有元素化合价升高,同时有元素化合价降低。反应中Cr元素化合价升高,则S元素的化合价降低,根据电子得失守恒可计算氧化剂和还原剂的物质的量之比。
(1) 装置中仪器a为分液漏斗。
答案为:分液漏斗;
(2) 装置C中黑色![]() 粉末变为红色固体,说明氧化铜被还原为铜单质,说明氨气具有还原性,量气管有无色无味的气体,根据元素守恒该气体肯定含有氮元素,只能是氮气,故方程式为2NH3 + 3CuO
粉末变为红色固体,说明氧化铜被还原为铜单质,说明氨气具有还原性,量气管有无色无味的气体,根据元素守恒该气体肯定含有氮元素,只能是氮气,故方程式为2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O。
3Cu + N2 + 3H2O。
答案为:还原性;2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
(3) 根据实验目的,需要测定D装置的质量变化来确定生成水的量,故E装置的作用是防止F中的水分进入D装置,同时浓硫酸还能吸收氨气。
答案为:防止F中的水分进入D装置,并吸收未反应的氨气;
(4) 为保证读出的气体体积为标准大气压下的体积,需要调整F装置,使两边液面相平。
答案为:调整F装置,使两边液面相平;
(5) 测得干燥管D增重m g,即生成m g水,装置F测得气体的体积为n L,即n L氮气,根据元素守恒,水中的氢元素都来自于氨气,氮气中的氮元素都来自于氨气,故氨分子中氮、氢的原子个数比为:![]() 。
。
答案为:![]() ;
;
(6) ① A装置特点为固液不加热制取气体,
A. Na2SO3 会被 HNO3氧化,A选项错误;
B. Na2SO3 固体与浓 H2SO4反应可生成SO2:Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O,B选项正确;
C. 碳与浓 H2SO4反应需加热:2H2SO4(浓) + C ![]() CO2↑ + 2SO2↑ + 2H2O,C选项错误;
CO2↑ + 2SO2↑ + 2H2O,C选项错误;
D. 铜与浓 H2SO4需加热:2H2SO4(浓) + Cu ![]() CuSO4 + 2H2O + SO2↑,D选项错误;
CuSO4 + 2H2O + SO2↑,D选项错误;
答案为:B;
② SO2不能和KI反应,所以将制得的 SO2通入淀粉碘化钾溶液,无明显现象;SO2不能将I- 氧化成I2,表明 SO2 的氧化性比 I2弱。
答案为:无明显现象;弱;
③ 将SO2通到NaOH溶液中,发生的反应先是:![]() ,n(NaOH):n(SO2)= 0.03:0.02=3:2,介于2:1和1:1之间,所以,所得溶质为Na2SO3和NaHSO3。
,n(NaOH):n(SO2)= 0.03:0.02=3:2,介于2:1和1:1之间,所以,所得溶质为Na2SO3和NaHSO3。
答案为:Na2SO3和NaHSO3。
④ 氧化还原反应中有元素化合价升高,同时有元素化合价降低。根据题意,Cr的化合价变化为:+6→+3,Cr2O72-为氧化剂,1mol Cr2O72-得电子2×(6-3)mol=6mol;则SO2被氧化为SO42-,SO2为还原剂,S的化合价变化为:+4→+6,1molSO2失电子(6-4)mol=2mol。根据电子得失守恒,氧化剂和还原剂的物质的量之比为:2:6=1:3。
答案为:1:3

【题目】根据下列实验和现象,所得实验结论正确的是( )
实验 | 现象 | 实验结论 | |
A | 向某溶液中先滴加适量硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-,SO32-,HSO3-中的一种或几种 |
B | 将纯碱和盐酸反应生成的气体,通入一定浓度Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:HCl>H2CO3>H2SiO3 |
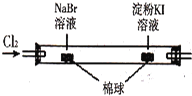
C |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D | 葡萄糖溶液与新制Cu(OH)2悬浊液混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
A.AB.BC.CD.D