题目内容
【题目】海水中蕴藏着丰富的资源。除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品。从海水中制取金属镁、溴的化工流程图如下:
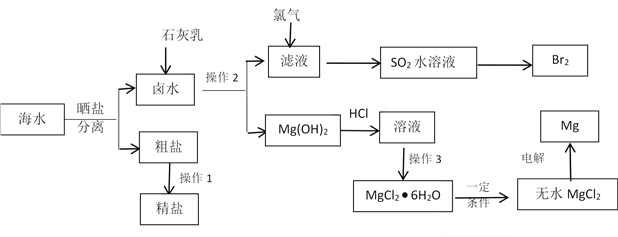
已知:MgO的熔点为28000C,MgCl2的熔点为7120C。
回答下列问题:
(1)操作2的方法是_____________,操作3具体指_____________________。
(2)操作1粗盐精制主要是要除掉粗盐中的Ca2+、Mg2+、SO42- 离子,以下试剂合理的组合是________
① 稀盐酸 ② NaOH ③ Na2CO3 ④ BaCl2
a.②③④① b.③②④① c.④②③① d.④③①②
(3)SO2水溶液可以起到富集溴的目的,该溶液吸收溴的离子反应方程式是____________ 。
(4)写出电解MgCl2制取Mg的化学方程式______________________。
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?_______(填“同意”或“不同意”),请说出你同意或不同意的理由____________________________。
【答案】 过滤 蒸发浓缩 降温结晶 c Br2 + SO2 + 2H2O ==== 2Br- + SO42- + 4H+ ![]() 不同意 MgO的熔点太高
不同意 MgO的熔点太高
【解析】(1)操作2是将固体和溶液分开,方法是过滤;从MgCl2溶液中获得MgCl2晶体,操作3具体指蒸发浓缩 降温结晶;(2)操作1粗盐精制主要是要除掉粗盐中的Ca2+、Mg2+、SO42- 离子,镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的次序为BaCl2、Na2CO3、NaOH、稀盐酸,故选C。(3)SO2水溶液可以起到富集溴的目的,溴将SO2氧化,该溶液吸收溴的离子反应方程式是 Br2 + SO2 + 2H2O= 2Br- + SO42- + 4H+;(4)电解MgCl2制取Mg的化学方程式![]() ;(5)不同意 ,MgO的熔点太高,,使其熔融所费能量太多,而MgCl2是离子晶体并且熔点低,熔融电解耗能少。
;(5)不同意 ,MgO的熔点太高,,使其熔融所费能量太多,而MgCl2是离子晶体并且熔点低,熔融电解耗能少。

【题目】(1) 工业上利用CO2生产甲醇燃料,反应方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。

①该反应在0-8 min内CO2的平均反应速率为_______。
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正_____v逆(填“>”、“<”或“=”)。
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是______,曲线Ⅱ改变的条件可能是________。
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1molCO2、3molH2 | xmolCO2、ymolH2、zmolCH3OH(g)、zmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为______。
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_______性,该溶液中各离子浓度由大到小的顺序为:________________,所得溶液中c(H+)-c(OH-)=___________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
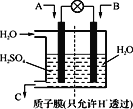
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为_____极,该极电极反应式为_______________。