题目内容
【题目】常温下,向a mol/L某弱酸HA溶液中滴加等体积的b mol/L氢氧化钠溶液恰好使溶液呈中性。则该温度下,HA的电离平衡常数表达式是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】B
【解析】
依据电荷守恒得到氢离子浓度和氢氧根离子浓度相同,常温下为10-7mol/L,弱酸HA的平衡常数只随温度变化,所以根据反应后的溶液中弱酸HA电离常数计算即可。
向amol.L-1某弱酸HA溶液中滴加等体积的bmol. L- 1氢氧化钠溶液恰好使溶液呈中性,所以c(H+)=c(OH- )= 10 -7mol/L;依据溶液中电荷守恒c(Na+)+c(H+)=c(OH- )+c(A-),此时溶液中c(Na+)=c(A- ),假设弱酸HA和氢氧化钠体积为1L,得到n(Na+) = bmol,n(HA)= amol,反应后溶液中弱酸HA的电离常数K=
![]() ,
,
故选B。

练习册系列答案
相关题目
【题目】根据下列实验和现象,所得实验结论正确的是( )
实验 | 现象 | 实验结论 | |
A | 向某溶液中先滴加适量硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-,SO32-,HSO3-中的一种或几种 |
B | 将纯碱和盐酸反应生成的气体,通入一定浓度Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:HCl>H2CO3>H2SiO3 |
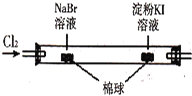
C |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D | 葡萄糖溶液与新制Cu(OH)2悬浊液混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
A.AB.BC.CD.D