题目内容
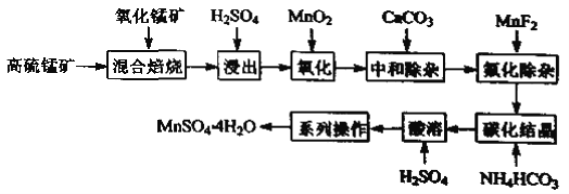
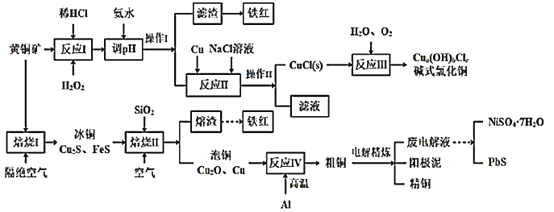
【题目】我国黄铜矿的储量比较丰富,主要产地集中在长江中下游地区、川滇地区、山西南部、甘肃的河西走廊以及西藏高原等地。黄铜矿是一种铜铁硫化物矿物,外观黄铜色,主要成分是CuFeS2,还含有少量的SiO2和Ni、Pb、Ag、Au等元素。为实现黄铜矿的综合利用,设计了如下的工艺流程。
已知:①a、b、c均为整数;②CuCl+2Cl-![]() CuCl32-。
CuCl32-。
(1)CuFeS2中S的化合价为___。铁红的主要成分是___(填化学式)。
(2)实验测得“反应I”中有SO42-生成,该反应离子方程式为___,选H2O2溶液优于HNO3的原因是___。
(3)“反应II”中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(4)写出“焙烧I”发生反应的化学方程式___。
(5)废电解液中含有少量的Pb2+,从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,若废电解液的pH=4,为保证不生成NiS沉淀,Ni2+浓度应控制在___以下。(已知:饱和H2S溶液中c(H2S)为0.1mol/L,H2S的电离常数Ka1=1.0×10-7,Ka2=2.0×10-15,Ksp(NiS)=1.4×10-16)
【答案】-2 Fe2O3 2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O 不引入杂质离子,无污染 氯离子浓度大,CuCl+2Cl-![]() CuCl32-平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少,产率 较低 2CuFeS2
CuCl32-平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少,产率 较低 2CuFeS2![]() Cu2S+2FeS+S 0.07mol/L
Cu2S+2FeS+S 0.07mol/L
【解析】
本题中存在两个流程,第一个流程目的是以黄铜矿为原料生产碱式氯化铜,黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),加入稀盐酸酸浸,SiO2不溶于稀盐酸,溶液中浸出Cu2+,Fe2+,Fe3+等离子,加入H2O2溶液,酸性条件下H2O2将Fe2+氧化为Fe3+,加入氨水调节溶液pH,使Fe3+形成Fe(OH)3沉淀除去Fe3+,进行操作Ⅰ过滤,得到SiO2、Fe(OH)3滤渣,溶液中则存在Cu2+为主,还存在SO42-,加入Cu和NaCl溶液,反应生成CuCl沉淀,经过操作Ⅱ过滤得到CuCl(s)和滤液,加入H2O和O2发生反应Ⅲ,得到碱式氯化铜;
第二个流程中先将黄铜矿隔绝空气焙烧,得到Cu2S和FeS等,加入石英砂通入空气焙烧,生成Cu2O、Cu,熔渣为Fe2O3等,Cu2O、Cu与铝在高温下发生铝热反应得到粗铜,电解可得到精铜。
(1)根据呈电中性CuFeS2,Cu为+2价,Fe为+2价,所以S为-2价,铁红的主要成分是Fe2O3;
(2)实验测得反应I中有SO42-生成,由S2-转化得到,H2O2作为氧化剂还会将CuFeS2中的二价铁氧化成三价,结合电子守恒和元素守恒可得方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
H2O2作为氧化剂其还原产物无污染,且不引入新的杂质,而HNO3的还原产物污染环境且引入杂质;
(3)根据题目提供信息CuCl+2Cl-![]() CuCl32-,当氯离子浓度过大时平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少;
CuCl32-,当氯离子浓度过大时平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少;
(4)根据流程可知产物中有Cu2S和FeS,通的化合价降低,则必有元素的化合价升高,反应物只有CuFeS2,铁元素化合价没变,可知S的化合价升高,又因为隔绝空气焙烧,所以氧化产物应为S单质,故方程式为:2CuFeS2![]() Cu2S+2FeS+S;
Cu2S+2FeS+S;
(5)饱和H2S溶液中c(H2S)为0.1mol/L,溶液pH=4,则溶液中c(H+)=10-4mol/L,根据Ka1=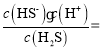 1.0×10-7,可解的c(HS-)约为10-4mol/L,根据Ka2=
1.0×10-7,可解的c(HS-)约为10-4mol/L,根据Ka2= 2.0×10-15,解得溶液中c(S2-)约为2.0×10-15mol/L,Ksp(NiS)=1.4×10-16=c(Ni2+)·c(S2-),所以为保证不生成NiS沉淀,Ni2+浓度应小于
2.0×10-15,解得溶液中c(S2-)约为2.0×10-15mol/L,Ksp(NiS)=1.4×10-16=c(Ni2+)·c(S2-),所以为保证不生成NiS沉淀,Ni2+浓度应小于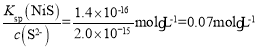 。
。

【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
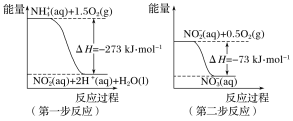
①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。
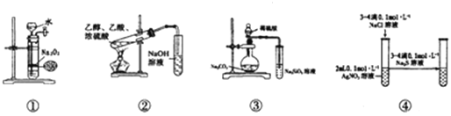
【题目】下列与实验现象对应的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向浓度为0.1mol/LNaCl、KI混合液中逐滴加入AgNO3溶液 | 出现黄色沉淀 | 溶解性:AgCl>AgI |
B | 溴乙烷与NaOH的乙醇溶液共热,将溢出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中有NH4+ |
D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
A.AB.BC.CD.D