题目内容
【题目】(1)已知碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11,草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
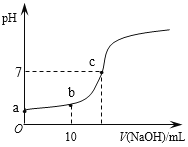
①0.1mol·L-1Na2CO3溶液的pH____0.1mol·L-1Na2C2O4溶液的pH。(填“大于”“小于”或“等于”)
②碳酸钠溶液显碱性的原因是_____________________________ 。(用主要的离子方程式表示)
③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是______(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(2)用氨水除去SO2。
已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=________mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________。
【答案】大于 CO32-+H2O![]() HCO3-+OH- ac 6.0×10-3 0.62
HCO3-+OH- ac 6.0×10-3 0.62
【解析】
(1)①根据碳酸Ka2=5.6×10-11<草酸 Ka2=6.4×10-5,酸性越弱,其强碱弱酸盐水解程度越大,碱性越强,则氢离子浓度越小,故答案为:大于;草酸;
②②碳酸钠溶液显碱性的原因是碳酸根在溶液中水解,发生反应CO32-+H2O![]() HCO3-+OH-,故答案为:CO32-+H2O
HCO3-+OH-,故答案为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
③草酸的两级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸的电离以第一步为主,因此溶液中c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-),故答案为:ac;
(2)由NH3·H2O的电离方程式及其电离平衡常数Kb=1.8×10-5可知,Kb=![]() =1.8×10-5,当氨水的浓度为2.0 mol/L时,溶液中的c(NH4+)=c(OH-)=6.0×10-3mol/L,故答案为6.0×10-3;
=1.8×10-5,当氨水的浓度为2.0 mol/L时,溶液中的c(NH4+)=c(OH-)=6.0×10-3mol/L,故答案为6.0×10-3;
由H2SO3的第二步电离方程式HSO3-SO32-+H+及其电离平衡常数Ka2=6.2×10-8可知,Ka2=![]() =6.2×10-8,将SO2通入该氨水中,当c(OH-)降至2.0×10-7mol/L时,溶液的c(H+)=1×10-7mol/L,则
=6.2×10-8,将SO2通入该氨水中,当c(OH-)降至2.0×10-7mol/L时,溶液的c(H+)=1×10-7mol/L,则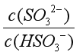 =0.62。
=0.62。

 英才计划期末调研系列答案
英才计划期末调研系列答案