题目内容
【题目】钼(Mo)是一种重要的过渡金属元素,钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂。以钼精矿(主要成分为MoS2)为原料制备金属钼和钼酸钠晶体的主要流程如图所示。

(1)Na2MoO4·2H2O 中钼元素的化合价为____________;
(2)在焙烧反应中,每生成1mol MoO3时转移电子数为:_______ (以NA表示阿伏加德罗常数的值);
(3)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____;
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________;
(5)结晶操作前需加入Ba(OH)2固体以除去溶液中的SO42-,SO42-的最大去除率是_____(结果保留一位小数)[已知:碱浸液中c(MoO42-)=0.80mol·L-1,(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=4.0×10-8,Ba(OH)2引起的溶液体积变化忽略。]
(6)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
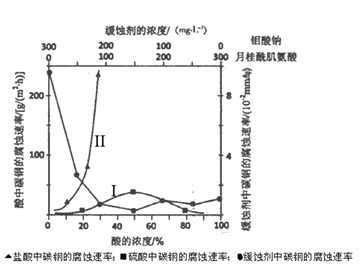
①试分析I、II曲线变化趋势不同的原因________________________________________
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________________________________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____________。
【答案】 +6 14NA ![]() 使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度 95.0% Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢 替代空气中氧气起氧化剂作用 1:1
使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度 95.0% Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢 替代空气中氧气起氧化剂作用 1:1
【解析】分析:本题以钼精矿为原料制备金属钼和钼酸钠晶体的流程为载体,考查流程的分析、氧化还原反应中转移电子数的计算、电子式的书写、与溶度积有关的计算、与碳钢腐蚀有关的图像分析。(1)根据化合物中元素的正负化合价代数和为0判断Mo的化合价。(2)根据流程写出方程式,用化合价升降法分析反应中转移电子数。(3)MoO3与Na2CO3生成Na2MoO4和CO2。(4)重结晶得到的母液使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度。(5)要求SO42-的最大去除率,计算MoO42-开始沉淀时溶液中c(Ba2+),进一步计算此时溶液中c(SO42-),从而确定SO42-的最大去除率。(6)①碳钢在盐酸、硫酸中腐蚀速率不同是由于阴离子的不同引起的;钢铁在浓硫酸中发生钝化。②分析题给信息,NaNO2替代空气中O2。③根据图像判断。
详解:(1)Na2MoO4·2H2O中Na元素的化合价为+1价,H元素的化合价为+1价,O元素的化合价为-2价,根据化合物中元素的正负化合价代数和为0,Mo元素的化合价为+6价。
(2)根据流程,焙烧时反应的化学方程式为2MoS2+7O2![]() 2MoO3+4SO2,在该反应中O元素的化合价全部由0价降至-2价,生成2molMoO3反应中转移28mol电子,则每生成1molMoO3转移14mol电子,转移电子数为14NA。
2MoO3+4SO2,在该反应中O元素的化合价全部由0价降至-2价,生成2molMoO3反应中转移28mol电子,则每生成1molMoO3转移14mol电子,转移电子数为14NA。
(3)操作1中,MoO3与Na2CO3溶液充分反应生成Na2MoO4和CO2,CO2的电子式为![]() 。
。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是:重结晶得到的母液使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度。
(5)SO42-达到最大去除率,要求MoO42-开始沉淀时的c(Ba2+)。MoO42-开始沉淀时溶液中c(Ba2+)=Ksp(BaMoO4)/c(MoO42-)=4![]() 10-8
10-8![]() 0.8=5
0.8=5![]() 10-8(mol/L),此时溶液中c(SO42-)=Ksp(BaSO4)/c(Ba2+)=1.0
10-8(mol/L),此时溶液中c(SO42-)=Ksp(BaSO4)/c(Ba2+)=1.0![]() 10-10
10-10![]() (5
(5![]() 10-8)=0.002(mol/L),SO42-的最大去除率为
10-8)=0.002(mol/L),SO42-的最大去除率为![]() 100%=95.0%。
100%=95.0%。
(6)①分析图像,I、II曲线变化的趋势是:随着盐酸浓度的增大,碳钢的腐蚀速率明显加快;随着硫酸浓度的增大,碳钢的腐蚀速率先加快后减慢;碳钢在盐酸中腐蚀速率比在硫酸中快。产生不同变化趋势的原因是:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得碳钢在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使碳钢钝化,腐蚀速率减慢。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2,NaNO2相当于空气,NaNO2的作用是:替代空气中氧气起氧化剂作用。
③根据图像,当钼酸钠和月桂酰肌氨酸都为150mg/L时,碳钢的腐蚀速率最慢,即要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比为1:1。