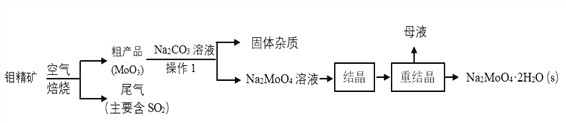
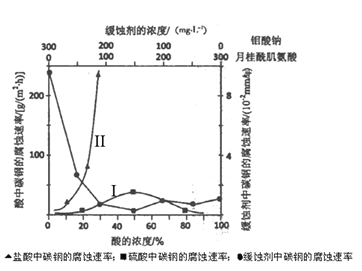
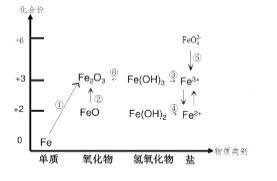
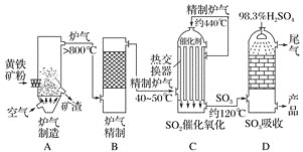
题目内容
【题目】(双选)下列各组离子中,中心原子的杂化轨道类型相同的是( )
A. NO、ClO B. SO![]() 、CO
、CO![]() C. NH、PH D. SO
C. NH、PH D. SO![]() 、SO
、SO![]()
【答案】CD
【解析】可以由VSEPR模型来判断离子的立体构型,再判断杂化轨道类型。A、NO中N原子上无孤电子对[ (5+1-3×2)=0],ClO中Cl原子上孤电子对数为1[ (7+1-3×2)=1],分别为平面三角形和三角锥形,N、Cl原子采取sp2和sp3杂化,选项A不选;B、SO![]() 中S原子上孤电子对数为1、CO
中S原子上孤电子对数为1、CO![]() 中C原子上无孤电子对,S、C原子分别采取sp3、sp2杂化,选项B不选;C、NH中N原子上孤电子对数为0、PH中S原子上孤电子对数为0,N、P原子均为sp3杂化,选项C选;D、SO
中C原子上无孤电子对,S、C原子分别采取sp3、sp2杂化,选项B不选;C、NH中N原子上孤电子对数为0、PH中S原子上孤电子对数为0,N、P原子均为sp3杂化,选项C选;D、SO![]() 中S原子上孤电子对数为1、SO
中S原子上孤电子对数为1、SO![]() 中S原子上孤电子对数为1,SO
中S原子上孤电子对数为1,SO![]() 、SO
、SO![]() 中S原子均为sp3杂化,选项D选。答案选CD。
中S原子均为sp3杂化,选项D选。答案选CD。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目