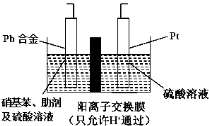
题目内容
【题目】过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。请回答下列问题:
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为_______________________________
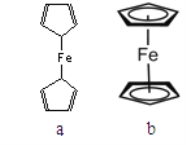
(2)二茂铁属于___________________晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为下图中的________________(选填“a”或“b”)
(3)环戊二烯(![]() )中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
)中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
(4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为______________。
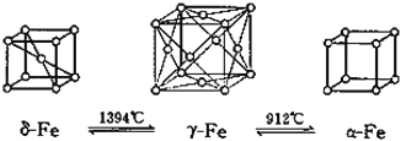
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是_______
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm-3,晶胞边长为4.28×10-10 m,则FexO中x=_____(用代数式表示,不要求算出具体结果)。
【答案】 3d6 分子晶体 b sp2、sp3 11NA π55 BC ![]() —
—![]()
【解析】分析:本题考查价电子排布式的书写、晶体类型的判断、杂化方式的判断和σ键的计算、大π键的分析、晶胞的分析和计算。
(1)基态Fe原子核外有26个电子,根据构造原理写出基态Fe的核外电子排布式,进一步写出基态Fe2+的价电子排布式。
(2)二茂铁熔、沸点较低,易升华,二茂铁属于分子晶体。a中有3种化学环境的H原子,b中只有1种化学环境的H原子,二茂铁的结构为图b。
(3)环戊二烯中4个双键C原子为sp2杂化,1个饱和C原子为sp3杂化。1个环戊二烯分子中有6个C-H键、3个碳碳单键、2个碳碳双键,单键全为σ键,双键中有1个σ键和1个π键,1个环戊二烯分子中有11个σ键。
(4)在C5H5-中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上,5个碳原子的5个p轨道肩并肩重叠形成大π键,其大π键可表示为π55。
(5)γ-Fe晶体中Fe的配位数为12;α-Fe晶体中Fe的配位数为6;用“均摊法”确定晶胞中原子个数,根据晶胞边长计算晶胞的体积,由晶胞体积、晶胞中原子个数和NA计算1mol晶体体积,进一步计算晶体的密度。
(6)用“均摊法”确定晶胞中微粒的个数,由晶胞边长计算晶胞的体积,根据晶胞体积、晶胞中原子个数、NA计算1mol晶体的体积,1mol晶体体积和晶体密度计算1mol晶体的质量,1mol晶体的质量以g为单位数值上等于相对分子质量,进一步计算x。
详解:(1)基态Fe原子核外有26个电子,根据构造原理,基态Fe原子的核外电子排布式为[Ar]3d64s2,基态Fe2+离子的核外电子排布式为[Ar]3d6,基态Fe2+离子的价电子排布式为3d6。
(2)二茂铁熔点(173℃)、沸点(249℃)较低,易升华(在100℃时开始升华),二茂铁属于分子晶体。a中有3种化学环境的H原子,b中只有1种化学环境的H原子,二茂铁中所有H原子的化学环境都相同,二茂铁的结构为图b。
(3)环戊二烯中4个双键C原子为sp2杂化,1个饱和C原子为sp3杂化。1个环戊二烯分子中有6个C-H键、3个碳碳单键、2个碳碳双键,单键全为σ键,双键中有1个σ键和1个π键,1个环戊二烯分子中有11个σ键,1mol环戊二烯中含11molσ键,1mol环戊二烯中含σ键的数目为11NA。
(4)在C5H5-中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上,5个碳原子的5个p轨道肩并肩重叠形成大π键,其大π键可表示为π55。
(5)A项,γ-Fe晶体属于面心立方最密堆积,γ-Fe晶体中Fe的配位数为12,即γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有12个,A项错误;B项,α-Fe晶体属于简单立方堆积,α-Fe晶体中Fe的配位数为6,即α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个,B项正确;C项,用“均摊法”,1个δ-Fe晶胞中含Fe:8![]() +1=2个,1个α-Fe晶胞中含Fe:8
+1=2个,1个α-Fe晶胞中含Fe:8![]() =1个,δ-Fe晶胞的体积为a3cm3,1molδ-Fe晶体的体积为a3cm3
=1个,δ-Fe晶胞的体积为a3cm3,1molδ-Fe晶体的体积为a3cm3![]() 2
2![]() NA,α-Fe晶胞的体积为b3cm3,1molα-Fe晶体的体积为b3cm3
NA,α-Fe晶胞的体积为b3cm3,1molα-Fe晶体的体积为b3cm3![]() NA,则δ-Fe晶体与α-Fe晶体的密度之比为b3:
NA,则δ-Fe晶体与α-Fe晶体的密度之比为b3:![]() =2b3:a3,C项正确;D项,将铁加热到1500℃分别急速冷却和缓慢冷却,分别得到α-Fe、δ-Fe,得到的晶体类型不同,D项错误;答案选BC。
=2b3:a3,C项正确;D项,将铁加热到1500℃分别急速冷却和缓慢冷却,分别得到α-Fe、δ-Fe,得到的晶体类型不同,D项错误;答案选BC。
(6)晶胞结构为NaCl型,1个晶胞中含4个O2-;晶胞的体积为(4.28![]() 10-8cm)3,1mol晶体的体积为(4.28
10-8cm)3,1mol晶体的体积为(4.28![]() 10-8cm)3
10-8cm)3![]() 4
4![]() NA,1mol晶体的质量为5.71g/cm3
NA,1mol晶体的质量为5.71g/cm3![]() [(4.28
[(4.28![]() 10-8cm)3
10-8cm)3![]() 4
4![]() NA]=
NA]=![]() g,FexO的相对分子质量为
g,FexO的相对分子质量为![]() ,56x+16=
,56x+16=![]() ,FexO中x=
,FexO中x=![]() -
-![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
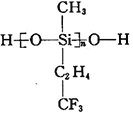
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(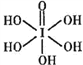 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
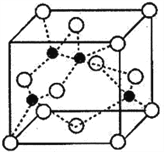
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④