题目内容
【题目】已知A原子中只含1个电子;B原子的3p轨道上得到1个电子后不容纳外来电子;C原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四电子层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)按要求书写下列图式。
①B原子的结构示意图:________;
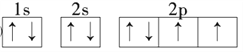
②C原子的电子排布图:________;
③D原子的核外电子排布式:________;
④B离子的电子式:________。
(2)写出由A、B、C、D中的三种元素组成的化合物的化学式:___________(至少写出5种)。
(3)写出由上述元素组成的物质制得A的单质的化学方程式:___________(至少写出2个)。
(4)写出E的元素符号:________,要证明太阳光中含有E元素,可采用的方法是________。
【答案】 
 1s22s22p63s23p64s1或[Ar]4s1 [
1s22s22p63s23p64s1或[Ar]4s1 [![]() ]- KOH、KClO、KClO3、HClO、HClO3(其他合理答案也可) 2H2O
]- KOH、KClO、KClO3、HClO、HClO3(其他合理答案也可) 2H2O![]() 2H2↑+O2↑ 2K+2H2O==2KOH+H2↑(其他合理答案也可) Ar 对太阳光进行光谱分析
2H2↑+O2↑ 2K+2H2O==2KOH+H2↑(其他合理答案也可) Ar 对太阳光进行光谱分析
【解析】A原子中只含1个电子,1个电子层,所以A为H;B原子的3p轨道上得到1个电子后不容纳外来电子,B为Cl;C原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反, C为O;D原子的第三电子层上有8个电子,第四电子层上只有1个电子, D为K;E原子的价电子排布式为3s23p6,E为Ar;
(1)
①Cl原子的结构示意图: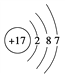 ;正确答案:
;正确答案: 。
。
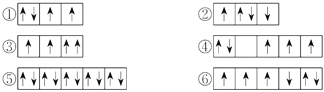
②O原子的电子排布图: ![]() ;正确答案:
;正确答案:![]() 。
。
③K原子的核外电子排布式:1s22s22p63s23p64s1或[Ar]4s1 ;正确答案: 1s22s22p63s23p64s1或[Ar]4s1 。
④Cl-离子的电子式: [![]() ]-;正确答案:[
]-;正确答案:[![]() ]-。
]-。
(2) 由H、Cl、O、K中的三种元素组成的化合物的化学式有多种,任意的五种为:KOH、KClO、KClO3、HClO、HClO3(其他合理答案也可);正确答案:KOH、KClO、KClO3、HClO、HClO3(其他合理答案也可)。
(3) 由H、O两种元素组成的化合物水,电解水可以制备氢气;由K和H元素形成化合物氢化钾与水反应生成氢气;金属钾与水反应生成氢气等;正确答案:2H2O![]() 2H2↑+O2↑; 2K+2H2O==2KOH+H2↑(其他合理答案也可)。
2H2↑+O2↑; 2K+2H2O==2KOH+H2↑(其他合理答案也可)。
(4) E元素为稀有气体氩,符号为Ar;对太阳光进行光谱分析,可以证明太阳光中含有Ar元素;正确答案:Ar;对太阳光进行光谱分析。

【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
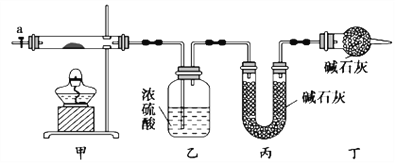
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
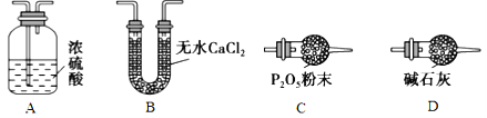
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
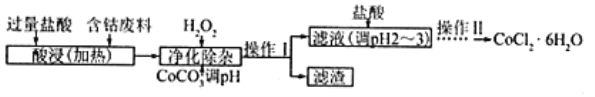
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。
【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
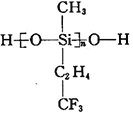
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(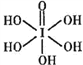 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)