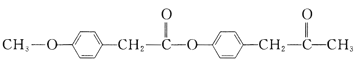
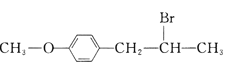
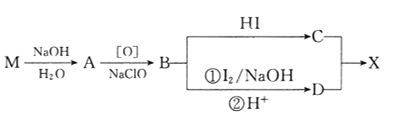
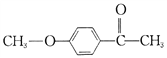
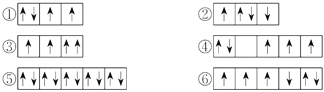
题目内容
【题目】反应:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑中被氧化的元素是( )
A.C
B.H
C.N
D.Ca
【答案】A
【解析】根据方程式可知HCN中碳元素化合价从+2价升高到+4价,失去电子,氢元素化合价从+1价降低到0价,得到电子,因此被氧化的元素是碳元素。
所以答案是:A

【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
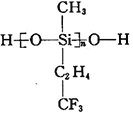
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(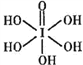 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
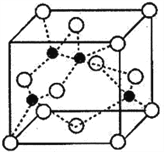
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④