题目内容
11.某混合物是由NaCl、MgCl2、AlCl3三种物质组成的,Na、Mg、Al三种元素的质量比为23:12:9.求:(1)NaCl、MgCl2、AlCl3的物质的量的比;
(2)氯离子为18mol时,混合物的质量?
分析 (1)设Na、Mg、Al三种元素的质量分别23g、12g、9g,根据n=$\frac{m}{M}$计算各自物质的量,根据原子守恒计算NaCl、MgCl2、AlCl3的物质的量,进而计算三者物质的量之比;
(2)结合(1)中NaCl、MgCl2、AlCl3的物质的量之比,计算各物质的量的物质的量,再根据m=nM计算出混合物的质量.
解答 解:(1)设Na、Mg、Al三种元素的质量分别23g、12g、9g,则:
则n(NaCl)=n(Na)=$\frac{23g}{23g/mol}$=1mol,
n(MgCl2)=n(Mg)=$\frac{12g}{24g/mol}$=0.5mol,
n(AlCl3)=n(Al)=$\frac{9g}{27g/mol}$=$\frac{1}{3}$mol,
故NaCl、MgCl2、AlCl3的物质的量的比为1mol:0.5mol:$\frac{1}{3}$mol=6:3:2,
答:NaCl、MgCl2、AlCl3的物质的量的之比为6:3:2;
(2)设三者的物质的量分别为6x、3x、2x,则6x+3x×2+2x×3=18,解得x=1,则混合物的质量为:58.5g/mol×1×6mol+95g/mol×1×3mol+133.5g/mol×1×2mol=903g,
答:氯原子为18mol时,混合物的质量为903g.
点评 本题考查混合物有关计算、物质的量计算,题目难度不大,注意掌握以物质的量为中心的有关计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.工业上生产苯乙烯是利用乙苯在560℃时的脱氢反应:
C8H10(g)?C8H8(g)+H2(g)
(乙苯) (苯乙烯)
针对上述反应,有人提出如下观点,其中合理的是( )
C8H10(g)?C8H8(g)+H2(g)
(乙苯) (苯乙烯)
针对上述反应,有人提出如下观点,其中合理的是( )
| A. | 在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率 | |
| C. | 在反应达到平衡过程中,体系的平均相对分子质量在不断增大 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件 |
6.下列反应的离子方程式正确的是( )
| A. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| B. | 硝酸银溶液中滴加过量氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| C. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O═H2↑+Cl2↑+2OH- | |
| D. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
16.人类的生产生活离不开化学,下列关于生活中的化学知识说法错误的是( )
| A. | 削皮后的苹果应立即吃掉,不能在空气中放置太久 | |
| B. | 明矾溶于水最终可形成的Al(OH)3胶体,能吸附水中悬浮物以净化水 | |
| C. | 可用Na2CO3 治疗胃酸过多 | |
| D. | 不需要通过化学反应就能从海水中获得食盐和淡水 |
3.同周期的A、B、C三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3CO4<H2BO4<HAO4,则下列判断正确的是( )
| A. | 主族序数按A、B、C的顺序依次减小 | |
| B. | 非金属性 A>B>C | |
| C. | 气态氢化物的稳定性按A、B、C的顺序由弱到强 | |
| D. | 原子半径 A>B>C |
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2.8 g N2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12L O2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L 0.1mol/L 的NH4NO3溶液中氧原子数为0.3NA |
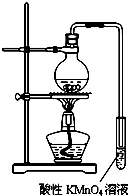 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.