题目内容
4.工业上生产苯乙烯是利用乙苯在560℃时的脱氢反应:C8H10(g)?C8H8(g)+H2(g)
(乙苯) (苯乙烯)
针对上述反应,有人提出如下观点,其中合理的是( )
| A. | 在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率 | |
| C. | 在反应达到平衡过程中,体系的平均相对分子质量在不断增大 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件 |
分析 A、增大乙苯浓度,增大了反应的压强,平衡向着逆向移动;
B、压强一定,充入不参加反应的气体,各组分的浓度减小;
C、根据反应中气体的质量以及物质的量的变化结合M=$\frac{m}{n}$进行判断;
D、根据压强对该反应的影响进行分析.
解答 解:A、在保持体积一定的条件下,充入较多的乙苯,反应体系的压强增大,平衡向着逆向移动,乙苯的转化率降低,故A错误;
B、保持压强一定的条件下,充入稀有气体,相当于减小了各组分的浓度,生成物浓度减小的程度大,平衡向着正向移动,苯乙烯的产量增加,故B正确;
C、在反应达到平衡过程中,体系的气体质量不变,物质的量增加,所以平均相对分子质量在不断减小,故C错误;
D、该反应是体积增大的反应,恒容体系中,随着反应的进行,体系的压强增大,平衡向着逆向移动,不利于苯乙烯的生成,故恒压条件优于恒容条件,故D错误;
故选B.
点评 本题考查了化学平衡的调控,注意分析反应的特点,吸热反应还是放热反应、反应两边气体体积增大还是减小,根据平衡移动原理进行分析即可,本题难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列有关氯水的叙述中正确的是( )
| A. | 新制氯水只含有氯分子和次氯酸分子 | |
| B. | 氯水光照时有气泡逸出,该气体的主要成分是氯气 | |
| C. | 氯水放置数天后,其酸性逐渐减弱 | |
| D. | 新制氯水可使紫色石蕊试液先变红后褪色 |
15.已知:H2(g)+F2(g)═2HF(g),反应过程的能量变化如下图,下列说法正确的是( )


| A. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ | |
| B. | 氟化氢气体分解生成氢气和氟气的反应是吸热反应 | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 其它条件不变,加入催化剂,该反应的△H减小 |
12.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | NaCl溶液中滴入AgNO3溶液 | B. | 氢气还原氧化铜 | ||
| C. | 铁片置于CuSO4溶液中 | D. | 一氧化碳的燃烧 |
19.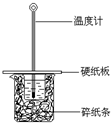 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )| A. | 实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若将盐酸体积改为60 mL,理论上所求中和热不相等 |
16.制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现
①Si(固)+3HCl(气)$\frac{\underline{\;300℃\;}}{\;}$ SiHCl3(气)+H2(气)
②SiHCl3+H2 $\frac{\underline{\;950℃\;}}{\;}$Si+3HCl
对上述两个反应的叙述中,错误的是( )
①Si(固)+3HCl(气)$\frac{\underline{\;300℃\;}}{\;}$ SiHCl3(气)+H2(气)
②SiHCl3+H2 $\frac{\underline{\;950℃\;}}{\;}$Si+3HCl
对上述两个反应的叙述中,错误的是( )
| A. | 两个反应都是置换反应 | B. | 据反应条件无法判断反应是否吸热 | ||
| C. | 两个反应互为可逆反应 | D. | 两个反应都是氧化还原反应 |
13.砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是( )
| A. | 黄砷的熔点高于白磷 | B. | 黄砷中共价键键能大于白磷 | ||
| C. | 黄砷分子极性大于白磷 | D. | 分子中共价键键角均为109°28′ |