题目内容
【题目】利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.2kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式 .
(2)为了探究反应条件对反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1的影响,某活动小组设计了三个实验,实验曲线如图所示.
编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
Ⅰ | 530℃ | 3MPa | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅱ | X | Y | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅲ | 630℃ | 5MPa | 1.0molL﹣1 | 3.0molL﹣1 |
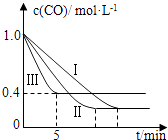
①请依据实验曲线图补充完整表格中的实验条件:X=℃,Y=MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=molL﹣1min﹣1 .
③实验Ⅱ达平衡时CO的转化率实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将(填“向正方向”、“向逆方向”或“不”) 移动.
【答案】
(1)CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol
(2)530;5;0.12;大于;向逆方向
【解析】解:(1)根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol;(2)①由图表可知,曲线II和曲线I相比,平衡不移动,只是缩短了反应达平衡的时间,故II和I不同的条件为压强,且为增大压强,故Y为5MPa,两者的温度应相同,故X为530℃,故答案为:530;5;②由图象可知,CO的平衡浓度为0.4mol/L,即可知△c(CO)=0.6mol/L,根据反应速率的公式V(CO)= ![]() =0.12molL﹣1min﹣1 .
=0.12molL﹣1min﹣1 .
故答案为:0.12;③CO的平衡浓度越大,则其平衡转化率越低,故实验Ⅱ达平衡时CO的转化率大于实验Ⅲ达平衡时CO的转化率,故答案为:大于;④若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),则此时反应的浓度商Qc= ![]() =2.5>K,则此时反应应向逆反应方向移动,故答案为:向逆方向.
=2.5>K,则此时反应应向逆反应方向移动,故答案为:向逆方向.
(1)再根据盖斯定律来计算反应的焓变,根据热化学方程式的书写规律来书写热化学方程式;(2)①由图表可知,曲线II和曲线I相比,平衡不移动,只是缩短了反应达平衡的时间,据此分析反应II的条件;②由图象可知,CO的平衡浓度为0.4mol/L,即可知△c(CO)=0.6mol/L,根据反应速率的公式求算;③CO的平衡浓度越大,则其平衡转化率越低;④求出反应的浓度商Qc,与K做比较即可.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4 , 过滤;
Ⅱ.向滤液中加入过量MnO2 , 过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是
(2)将MnO2氧化Fe2+的离子方程式补充完整: MnO2+ Fe 2++ ═ Mn 2++ Fe 3++
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 .
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 .
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4﹣与Mn2+反应生成MnO2 . 取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 .