题目内容
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4 , 过滤;
Ⅱ.向滤液中加入过量MnO2 , 过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是
(2)将MnO2氧化Fe2+的离子方程式补充完整: MnO2+ Fe 2++ ═ Mn 2++ Fe 3++
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 .
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 .
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4﹣与Mn2+反应生成MnO2 . 取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 .
【答案】
(1)二氧化硅
(2)1;2;4H+;1;2;2H2O
(3)不会引入Cl﹣ , 使制得的MnSO4?H2O产品更纯净
(4)4.7≤a<7.6
(5)![]()
【解析】解:菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2),加入过量稀H2SO4 , 生成硫酸锰、硫酸亚铁、硫酸铝溶液,二氧化硅不溶解,;向滤液中加入过量MnO2 , 将亚铁离子氧化为铁离子,本身被还原为二价锰离子,调节滤液pH,使三价铁离子和铝离子沉淀,过滤除去氢氧化铁和氢氧化铝固体,对硫酸锰溶液进行浓缩、冷切结晶、过滤、洗涤干燥得到产品,(1)菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2),加入过量稀H2SO4 , 生成硫酸锰、硫酸亚铁、硫酸铝溶液,二氧化硅不溶解,滤渣的主要成分是二氧化硅,
所以答案是:二氧化硅;(2)锰元素化合价由+4价降低到+2价,铁元素由+2价升高到+3价,根据化合价升降守恒、电荷守恒、原子守恒,配平反应为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
所以答案是:1、2+4H+、1、2、2H2O;(3)选用Cl2作为氧化剂会最后的溶液中引入氯离子,使制得的产品不纯,而MnO2不会引入Cl﹣ , 使制得的MnSO4H2O产品更纯净,
所以答案是:不会引入Cl﹣ , 使制得的MnSO4H2O产品更纯净;(4)调节滤液pH,使三价铁离子和铝离子沉淀,根据表格可知二价锰离子开始沉淀的pH=7.6,铝离子开始沉淀的pH=4.7,故4.7≤a<7.6,
所以答案是:4.7≤a<7.6;(5)设含有硫酸锰的物质的量为z,根据方程式
3Mn2+ | + | 2MnO4﹣ | + | 2H2O | = | 5MnO2 | + | 4H+ |
3mol | 2mol | |||||||
z | 0.1y×10﹣3mol |
z=0.15y×10﹣3mol,
锰元素的质量分数= ![]() ,
,
所以答案是: ![]() .
.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.2kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式 .
(2)为了探究反应条件对反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1的影响,某活动小组设计了三个实验,实验曲线如图所示.
编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
Ⅰ | 530℃ | 3MPa | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅱ | X | Y | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅲ | 630℃ | 5MPa | 1.0molL﹣1 | 3.0molL﹣1 |
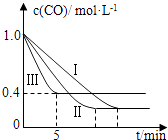
①请依据实验曲线图补充完整表格中的实验条件:X=℃,Y=MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=molL﹣1min﹣1 .
③实验Ⅱ达平衡时CO的转化率实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将(填“向正方向”、“向逆方向”或“不”) 移动.