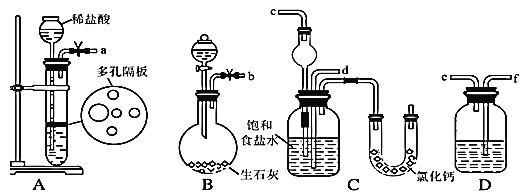
题目内容
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
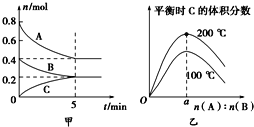
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
【答案】B
【解析】
由图甲可以知道反应中A、B、C的物质的量的变化量为0.4:0.2:0.2=2:1:1,根据反应中化学计量数之比等于物质的量的变化量之比可以知道,该反应方程式为 2A(g)+B(g)C(g);
A.根据v=△c/△t,可以知道v(B)= ![]() ,故A错误;
,故A错误;
B.由图可以知道平衡时A、B、C的物质的量分别为0.4mol、0.2mol、0.2mol,所以它们的浓度分别为:0.2mol/L、0.1mol/L、0.1mol/L,结合化学方程式2A(g)+B(g)C(g),可以知道该反应的平衡常数K=0.1/(0.22×0.1)=25,故B正确;
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均减小,故C错误;
D.由图乙可以知道,n(A):n(B)一定时,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,△H>0,故D错误。答案选B。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)(实验原理)
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
(2)(实验装置)如图1所示。

(实验过程与记录)
实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入25mL1molL﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1molL﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2)_____(填写支持实验结论的证据) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____(填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____。
【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D