题目内容
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
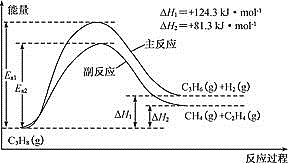
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)______(填“增大”、“减小”或“不变”)
②温度升高,副反应更容易发生的主要原因是:_____________________________。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)
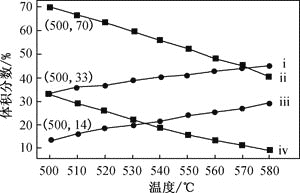
①104Pa时,图中表示丙烯的曲线是_________(填“i”、“ii”、“iii”或“iv”)
②104Pa、500℃时,主反应用平衡分压代替平黄浓度表示的化学平衡常数Kp=______(已知:气体分压=气体总压×体积分数)
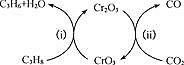
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图
已知:CO和H2的燃烧热分别为H=-283.0kJ·mol-1、H=-285.8kJ·mol-1
①图中催化剂为___________。
②298K时,该工艺总反应的热化学方程式为____________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是____________。
【答案】增大 副反应的活化能低于主反应的活化能 ⅰ 3.3×103Pa CrO3 C3H8(g)+CO2C3H6(g)+CO(g)+H2O(l) △H =+121.5kJ/mol 碳与CO2反应生成CO,脱离催化剂表面
【解析】
(1)①反应温度升高,平衡向正反应方向移动;
②由图可知,副反应的活化能低于主反应的活化能;
(2)①丙烷脱氢制丙烯为气体体积增大的反应;
②由题意建立三段式,结合公式计算分压常数;
(3)①由图可知,CrO3为催化剂;
②由盖斯定律计算可得;
③该工艺中碳与CO2反应生成CO。
(1)①由图可知,丙烷脱氢制丙烯为吸热反应:C3H8(g)C3H6(g)+H2(g) △H =+124.3 kJ/mol,恒压时若向原料气中掺入水蒸气,体系温度升高,平衡向正反应方向移动,化学平衡常数K增大,故答案为增大;
②由图可知,副反应的活化能低于主反应的活化能,温度升高,活化能较低的副反应更容易发生,故答案为副反应的活化能低于主反应的活化能;
(2)①丙烷脱氢制丙烯为气体体积增大的反应,增大压强,平衡向逆反应方向移动,丙烯的平衡体积分数减小;该反应为吸热反应,温度升高,平衡向正反应方向移动,故曲线ⅰ代表104 Pa时丙烯的平衡体积分数,故答案为ⅰ;
②104 Pa、500 ℃时,丙烯的平衡体积分数为33%,设起始丙烷为1mol,转化率为x,由题意建立如下三段式:
C3H8(g)C3H6(g)+H2(g)
起(mol) 1 0 0
变(mol) x x x
平(mol) 1-x x x
则由丙烯的平衡体积分数为33%可得,x/(1+x)=0.33,解得x≈0.5,丙烷、丙烯和氢气的分压均为104Pa×1/3,则用平衡分压代替平衡浓度表示的化学平衡常数Kp=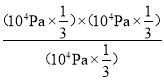 =104Pa×
=104Pa×![]() =3.3×103Pa,故答案为3.3×103Pa;
=3.3×103Pa,故答案为3.3×103Pa;
(3)①由图可知,反应ⅰ为3C3H8+2CrO33C3H6+Cr2O3+3H2O,反应ⅱ为3CO2+Cr2O32CrO3+3CO,则催化剂为CrO3,故答案为CrO3;
②由题意可得H2(g)+1/2O2(g)=H2O(l) △H =-285.8kJ/mol①CO(g)+1/2O2(g)=CO2 (g) △H =-283.0kJ/mol②C3H8(g)C3H6(g)+H2(g)△H =+124.3 kJ/mol③,由盖斯定律③-②+①得热化学方程式C3H8(g)+CO2C3H6(g)+CO(g)+H2O(l),则△H =(+124.3 kJ/mol)+(-285.8kJ/mol)-(-283.0kJ/mol)=+121.5kJ/mol,故答案为C3H8(g)+CO2C3H6(g)+CO(g)+H2O(l) △H =+121.5kJ/mol;
③该工艺中碳与CO2反应生成CO,可以有效消除催化剂表面的积炭,维持催化剂活性,故答案为碳与CO2反应生成CO,脱离催化剂表面。