题目内容
7.下列叙述正确的是( )| A. | 物质的量浓度相同的溶液中所含溶质的微粒数相同 | |
| B. | 常温常压下,0.1molH2气体约含6.02×1022个H2分子 | |
| C. | 1mol•L-1醋酸溶液100mL中H+的个数约为0.1NA | |
| D. | 标准状况下,1molH2O的体积约22.4L |
分析 A.体积未知,不能确定物质的量以及粒子数目;
B.根据N=nNA计算;
C.醋酸为弱酸,不能完全电离;
D.标准状况下,水为液体,Vm≠22.4L/mol.
解答 解:A.由n=cV可知,体积未知,不能确定物质的量以及粒子数目,故A错误;
B.N=nNA=6.02×1022,故B正确;
C.醋酸为弱酸,不能完全电离,H+的个数小于0.1NA,故C错误;
D.标准状况下,水为液体,Vm≠22.4L/mol,故D错误.
故选B.
点评 本题考查物质的量的相关概念,为高频考点,注意把握相关概念的理解以及相关公式的运用,难度不大,易错点为D,注意气体摩尔体积的适用范围.

练习册系列答案
相关题目
17.常温下,下列各组比值为1:2的是( )
| A. | 0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 | |
| B. | 0.1 mol/L H2S溶液,c(S2-)与c(H+)之比 | |
| C. | pH=10的Ba(OH)2溶液与pH=10的氨水,溶质的物质的量浓度之比 | |
| D. | pH=3的硫酸与pH=3的醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
18.丁香酚是一种有特殊香味的液体,它的结构简式是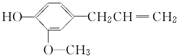 ,丁香酚不具有的性质是( )
,丁香酚不具有的性质是( )
 ,丁香酚不具有的性质是( )
,丁香酚不具有的性质是( )| A. | 与金属钠反应 | B. | 与NaOH溶液反应 | ||
| C. | 与碳酸钠反应放出CO2 | D. | 能发生加成反应 |
2.下列化学反应中,属于放热反应的是( )
| A. | Al+稀盐酸 | B. | Ba(OH)2•8H2O+NH4Cl(固体) | ||
| C. | KClO3受热分解 | D. | C和CO2反应 |
12.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率为0.8mol•L-1•s-1,是指在1s时某物质的浓度是0.8mol•L-1 | |
| B. | 化学反应速率是指在一段时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 | |
| C. | 化学反应速率可以衡量化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象越明显 |
19.下列叙述正确的是( )
| A. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| B. | 、SiO2是酸性氧化物,能与NaOH溶液反应 | |
| C. | 、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | .除去石英中的少量碳酸钙,用稀硫酸溶解后过滤分离 |
16.将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应:
①2N2O5(g)?2N2O4(g)+O2(g);②N2O4(g)?2NO2(g).达到平衡时,c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则此温度下反应①的平衡常数为( )
①2N2O5(g)?2N2O4(g)+O2(g);②N2O4(g)?2NO2(g).达到平衡时,c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 3.2 | B. | 0.2 | C. | $\frac{1}{180}$ | D. | $\frac{4}{45}$ |
17.依据下表所列实验及现象得出的结论不正确的是( )
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C(Vc) | 溶液褪色为浅绿色 |
| Fe(OH)3胶体通直流电 | 阴极附近红褐色加深 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C(Vc)具有还原性 | B. | Fe(OH)3胶体粒子带正电荷 | ||
| C. | 铜锈与盐酸反应有H2生成 | D. | 铜锈中含有碳酸根 |