题目内容
17.常温下,下列各组比值为1:2的是( )| A. | 0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 | |
| B. | 0.1 mol/L H2S溶液,c(S2-)与c(H+)之比 | |
| C. | pH=10的Ba(OH)2溶液与pH=10的氨水,溶质的物质的量浓度之比 | |
| D. | pH=3的硫酸与pH=3的醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
分析 A.醋酸为弱酸,溶液浓度不同,电离程度不同;
B.硫化氢为二元弱酸,主要以第一步电离为主,c(S2-)远远小于c(H+);
C.一水合氨是弱电解质,溶液中存在电离平衡,所以氨水的浓度大于氢氧根离子浓度;
D.H+离子的浓度相等,则OH-的浓度相等,结合电荷守恒判断.
解答 解:A.醋酸为弱酸,溶液浓度不同,电离程度不同,浓度越大,电离程度越小,则0.1 mol/L与0.2 mol/L醋酸溶液中的c(H+)之比大于1:2,故A错误;
B.CO32-水解,溶液中含有HCO3-,Na2CO3溶液中c(Na+)与c(CO32-)之比大于2:1,故B错误;
C.pH=10的Ba(OH)2溶液与氨水,c(Ba(OH)2)=$\frac{1}{2}$×c(OH-)=0.00005mol/L,c(氨水)>0.0001mol/L,溶质的物质的量浓度之比小于1:2,故C错误,故C错误;
D.H+离子的浓度相等,则OH-相同,由电荷守恒可知,两种溶液中分别存在c(H+)=2c(SO42-)+c(OH-)、c(H+)=c(CH3COO-)+c(OH-),则2c(SO42-)=c(CH3COO-),c(SO42-)与c(CH3COO-)之比为1:2,故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,注意掌握盐类的水解原理、弱电解质的电离特点,能够从溶液电中性的角度比较离子浓度的大小关系.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
4.不加其他试剂就无法鉴别的一组无色溶液是( )
| A. | NH4NO3、Na2SO4、CuSO4、MgCl2 | B. | MgCl2、BaCl2、NaOH、H2SO4 | ||
| C. | NaBr、AgNO3、HCl、KI | D. | NaNO3、BaCl2、Na2CO3、H2SO4 |
5.现有一种烃可以表示为  命名该化合物时,应认定它的主链上的碳原子数目为( )
命名该化合物时,应认定它的主链上的碳原子数目为( )
 命名该化合物时,应认定它的主链上的碳原子数目为( )
命名该化合物时,应认定它的主链上的碳原子数目为( )| A. | 9 | B. | 10 | C. | 11 | D. | 12 |
12.在强酸性无色溶液中,能大量共存的离子组是( )
| A. | Al3+、MnO4-、SO42-、Cl- | B. | Ba2+、K+、OH-、Cl- | ||
| C. | NH4+、Mg2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CH3COO- |
2.下列反应的离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2OA1O2═+4NH4++2H2O | |
| B. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| C. | 酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | 浓盐酸与铁屑反应:Fe+2H+═Fe2++H2↑ |
6.下列操作中仪器使用不正确的是( )
| A. | 用碱式滴定管盛装高锰酸钾溶液 | B. | 用铁坩埚灼烧烧碱 | ||
| C. | 用铁坩埚除去纯碱晶体中的结晶水 | D. | 加热蒸发皿时不用石棉网 |
7.下列叙述正确的是( )
| A. | 物质的量浓度相同的溶液中所含溶质的微粒数相同 | |
| B. | 常温常压下,0.1molH2气体约含6.02×1022个H2分子 | |
| C. | 1mol•L-1醋酸溶液100mL中H+的个数约为0.1NA | |
| D. | 标准状况下,1molH2O的体积约22.4L |
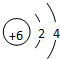 .
.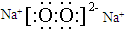 ;如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3 -.
;如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3 -.