题目内容
16.将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应:①2N2O5(g)?2N2O4(g)+O2(g);②N2O4(g)?2NO2(g).达到平衡时,c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 3.2 | B. | 0.2 | C. | $\frac{1}{180}$ | D. | $\frac{4}{45}$ |
分析 反应①的平衡常数k=$\frac{{c}^{2}({N}_{2}{O}_{4})×c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$,N2O5分解得到N2O4部分转化为NO2(g),平衡时c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则平衡时c(N2O4)=2c(O2)-$\frac{1}{2}$c(NO2),平衡时c(N2O5)=$\frac{1mol}{2L}$-2c(O2),代入平衡常数表达式计算.
解答 解:N2O5分解得到N2O4部分转化为NO2(g),平衡时c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则:
平衡时c(N2O4)=2c(O2)-$\frac{1}{2}$c(NO2)=0.2mol/L×2-$\frac{1}{2}$×0.6mol/L=0.1mol/L,
平衡时c(N2O5)=$\frac{1mol}{2L}$-2c(O2)=0.5mol/L-0.2mol/L×2=0.1mol/L,
故反应①的平衡常数k=$\frac{{c}^{2}({N}_{2}{O}_{4})×c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$=$\frac{0.{1}^{2}×0.2}{0.{1}^{2}}$=0.2,
故选B.
点评 本题考查化学平衡常数计算,关键是计算平衡时c(N2O4),难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列操作中仪器使用不正确的是( )
| A. | 用碱式滴定管盛装高锰酸钾溶液 | B. | 用铁坩埚灼烧烧碱 | ||
| C. | 用铁坩埚除去纯碱晶体中的结晶水 | D. | 加热蒸发皿时不用石棉网 |
7.下列叙述正确的是( )
| A. | 物质的量浓度相同的溶液中所含溶质的微粒数相同 | |
| B. | 常温常压下,0.1molH2气体约含6.02×1022个H2分子 | |
| C. | 1mol•L-1醋酸溶液100mL中H+的个数约为0.1NA | |
| D. | 标准状况下,1molH2O的体积约22.4L |
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| B. | 1L0.1 mol•L-1的碳酸氢钠溶液中含碳酸氢根离子数为0.1NA | |
| C. | 常温常压下,1.7gH2O2中含有的电子数为0.9nA | |
| D. | 8 Al+3 NH4ClO4═4 Al2O3+3NH3+3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA |
11.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐.

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 | |
| B. | 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3 | |
| C. | B和Cl2的反应是氧化还原反应 | |
| D. | 当X是强酸时,C在常温下是气态单质 |
1.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| C. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| D. | 由于W、Z元素的氢气化物还原性:W>Z |
8.将12g金属粉末混合物,加入足量稀硫酸中,至无气泡产生为止,共收集到氢气11.2L(标准状况下),此混合物可能是( )
| A. | Zn和Cu | B. | Al和Fe | C. | Ag和Zn | D. | Mg和Fe |
5.下列有关化学用语正确的是( )
| A. | Na+的基态电子排布图是: | |
| B. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1NA | |
| C. | Na2S的电子式: | |
| D. | 氯离子结构示意图为: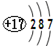 |
6.下列物质属于等电子体一组的是( )
| A. | CH3Cl和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、NO2 | D. | H2O和CH4 |