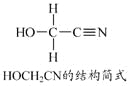
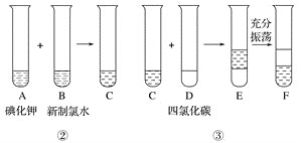
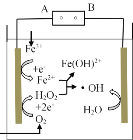
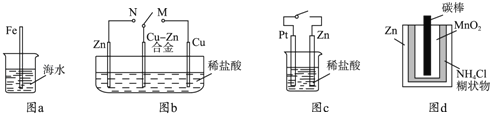
��Ŀ����
����Ŀ����ҵ������������Ҫ�ɷ�ΪAl2O3����Fe2O3�����ʣ�Ϊԭ��ұ�����Ĺ����������£�

�����������е��ж���ȷ����
A. �Լ�XΪϡ����
B. ������ӣ� H+����������ǿ������˳���ǣ�AlO2���� OH�� ��CO32��
C. ��ӦII������Al(OH)3�ķ�ӦΪ��CO2��AlO2�� ��2H2O ��Al(OH)3����HCO3��
D. Al2O3�۵�ܸߣ���ҵ�ϻ��ɲ��õ������AlCl3ұ��Al
���𰸡�C
��������
�ɹ�������ͼ��֪���Լ�X������������Һ��Al2O3��������������Һ�õ�NaAlO2��Һ��Fe2O3������������Һ����Ӧ�����Է�Ӧ�ٹ��˺�������Һ��ΪNaAlO2��Һ������ΪFe2O3��YΪCO2����NaAlO2��Һ��ͨ�����CO2�Ļ�ѧ����ʽΪNaAlO2+CO2+2H2O=Al(OH)3��+NaHCO3�����˷���������Al2O3�õ�����Al���Դ˽����⡣
A. ��������������������ֻ�����������Ƶ�ǿ����Һ��������ϡ���ᣬ�����������������Ʒ�Ӧ������������Ӧ�������߶�����ϡ���ᷴӦ����A����
B. �����������Խǿ����Ӧ����ų����ӵ�������Խ�������Ӧ������Ծ�Խ�������ԣ�HCO3�� > Al(OH)3>H2O�����Խ������������OH��>AlO2�� >CO32������B����
C. ������������֪����ӦII������Al(OH)3�ķ�ӦΪ��CO2��AlO2����2H2O ��Al(OH)3����HCO3������C��ȷ��
D. �Ȼ����Ƿ��Ӿ��壬����ʱ���ܵ�������ӣ�������ڵ��Ȼ������ܻ�ý���������D����
��ѡC��

����Ŀ��K��Al��Si��Cu��Ni��Ϊ��Ҫ�ĺϽ���ϣ��ڹ�ҵ�������Ƽ��������������Ź㷺����;����ش��������⣺
��1��KԪ�ش���Ԫ��ͬ�ڱ���_____����
��2������״̬�����У����������һ��������������������______�����ţ���
A. [Ne]![]() �� B.[Ne]
�� B.[Ne]![]()
![]() �� C.[Ne]
�� C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
�� �� 3s�� 3s��3p 3s��3p 3s��3p 3p
��3���Ӻ�������Ų��ǶȽ�������Cu2O��CuO���ȶ���ԭ����_____________��
��4��һЩ��������۵����±���ʾ��
������ | NaCl | KCl | SiO2 |
�۵�/��C | 801 | 770 | 1723 |
���ͱ��л�����֮���۵�����ԭ��________________________________��
��5��NiSO4���ڰ�ˮ�γ�[Ni(NH3)6]SO4��
��N��O��S����Ԫ���е縺��������_______��
��д��һ����[Ni(NH3)6]SO4�е������ӻ�Ϊ�ȵ�����ķ��ӵķ���ʽ_________��
��1mol[Ni(NH3)6]SO4�к�����������ĿΪ___________��
��NH3��VSEPRģ��Ϊ____��NH3��SO42-������ԭ�ӵ��ӻ����ͷֱ�Ϊ___��___��
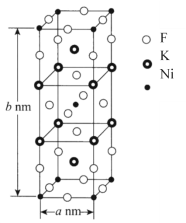
��6��K��Ni��F����Ԫ����ɵ�һ�־���ij����徧���ṹ��ͼ��ʾ����NAΪ�����ӵ�������ֵ���þ�����ܶ���=______g��cm-3(�ô���ʽ��ʾ)��