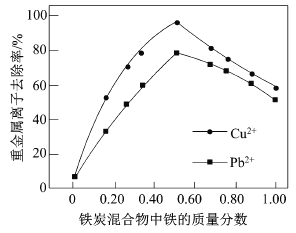
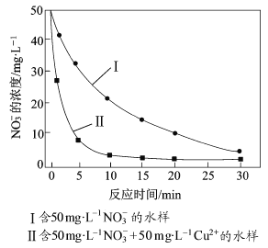
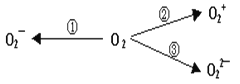
题目内容
【题目】[物质结构与性质]
[Zn(CN)4]2–在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2–+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2–中Zn2+与CN–的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2–的结构可用示意图表示为_____________。
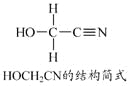
【答案】(1)1s22s22p62s23p63d10(或[Ar] 3d10) (2)3 (3)sp3和sp (4)NH2-
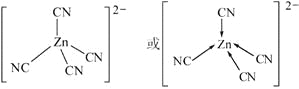
(5)
【解析】试题分析:(1)Zn是30号元素,Zn2+核外有28个电子,根据原子核外电子排布规律可知基态Zn2+核外电子排布式为1s22s22p62s23p63d10;
(2)甲醛的结构式是![]() ,由于单键都是σ键,双键中有一个σ键和一个π键,因此在一个甲醛分子中含有3个σ键和1个π键,所以在1 mol HCHO分子中含有σ键的数目为3 mol;
,由于单键都是σ键,双键中有一个σ键和一个π键,因此在一个甲醛分子中含有3个σ键和1个π键,所以在1 mol HCHO分子中含有σ键的数目为3 mol;
(3)根据HOCH2CN的结构简式可知在HOCH2CN分子中,连有羟基-OH的碳原子形成4个单键,因此杂化类型是sp3杂化,—CN中的碳原子与N原子形成三键,则其杂化轨道类型是sp杂化;
(4)原子数和价电子数分别都相等的是等电子体,H2O含有10个电子,则与H2O分子互为等电子体的阴离子为NH2-;
(5)在[Zn(CN)4]2–中Zn2+与CN-的C原子形成配位键,C原子提供一对孤对电子,Zn2+的空轨道接受电子对,因此若不考虑空间构型,[Zn(CN)4]2–的结构可用示意图表示为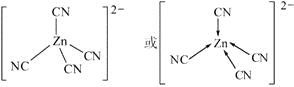 。
。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案