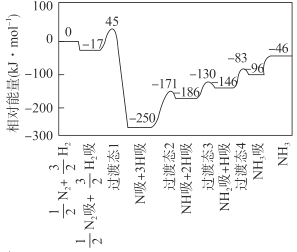
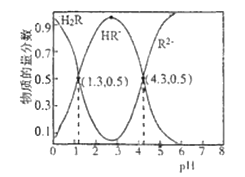
题目内容
【题目】实验室通常用氧化剂+浓盐酸![]() 金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
(1)反应过程中,被氧化的HCl的物质的量为____mol。
(2)反应后溶液中HCl的物质的量浓度为____mol·L-1。
【答案】0.05 9.00
【解析】
NaClO具有强氧化性,可与浓盐酸发生氧化还原反应生成氯气,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,反应中只有Cl元素化合价发生变化,结合反应的化学方程式计算。
(1)反应的化学方程式为NaClO+2HCl=Cl2↑+H2O+NaCl,n(Cl2)= ![]() =0.05mol,2molHCl参加反应,只有1mol被氧化,则生成0.05mol氯气,被氧化的HCl的物质的量为0.05mol,故答案为:0.05;
=0.05mol,2molHCl参加反应,只有1mol被氧化,则生成0.05mol氯气,被氧化的HCl的物质的量为0.05mol,故答案为:0.05;
(2)由方程式可知消耗0.1molHCl,则反应后溶液中HCl的物质的量浓度为![]() =9.00mol/L,故答案为:9.00。
=9.00mol/L,故答案为:9.00。

练习册系列答案
相关题目