题目内容
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
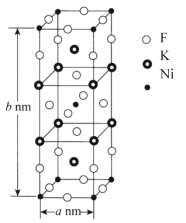
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。
【答案】s A 基态Cu+的价电子排布式为3d10,为全充满状态,更稳定(或“Cu+离子核外电子处于稳定的全充满状态”) NaCl、KCl为离子晶体,SiO2为原子晶体;K+半径大于Na+半径,晶格能NaCl >KCl O CX4、SiX4(X表示卤素原子,任写一种) 28NA 四面体形 sp3 sp3 ![]()
【解析】
(1)K元素的价电子排布式为4s1,最后的电子排在s轨道上,所以处于元素同期表的s区。
答案为s;
(2)在第三周期,轨道的能量3s<3p,电子的能量越低,电离时消耗的能量越高,所以3s轨道上的电子电离时消耗的能量最高。答案为A;
(3)从核外电子排布角度看,基态Cu+的价电子排布式为3d10,为全充满状态,更稳定。
答案为:基态Cu+的价电子排布式为3d10,为全充满状态,更稳定(或“Cu+离子核外电子处于稳定的全充满状态”)
(4)从表中可以看出,KCl、NaCl的熔点相近,而SiO2的熔点高。因为NaCl、KCl为离子晶体,SiO2为原子晶体,所以SiO2的熔点高;K+半径大于Na+半径,晶格能NaCl >KCl,所以NaCl的熔点高。
答案为:NaCl、KCl为离子晶体,SiO2为原子晶体;K+半径大于Na+半径,晶格能NaCl >KCl
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
① N、O、S三种元素中电负性最大的是O。答案为O
② [Ni(NH3)6]SO4中的阴离子为SO42-,它的价电子数为42,与它互为等电子体的分子为CX4、SiX4(X表示卤素原子,任写一种)。答案为CX4、SiX4(X表示卤素原子,任写一种)
③在[Ni(NH3)6]SO4中,[Ni(NH3)6]2+含有24个δ键,SO42-中含有4个δ键。所以1mol[Ni(NH3)6]SO4中含有δ键的数目为28NA。答案为28NA
④NH3的VSEPR模型为四面体。答案为四面体形
NH3的中心原子的杂化类型sp3,答案为sp3。
SO42-的中心原子的杂化类型为sp3,答案为sp3。
(6)从K、Ni、F三种元素组成的一种晶体的长方体晶胞结构图,我们可以得出该物质的化学式为K4Ni2F8,它的相对分子质量为426,则该晶体的密度
ρ= ![]() ×1023g·cm-3。答案为:
×1023g·cm-3。答案为:![]() 。
。

 特高级教师点拨系列答案
特高级教师点拨系列答案