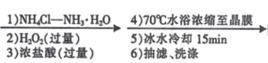
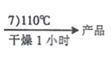
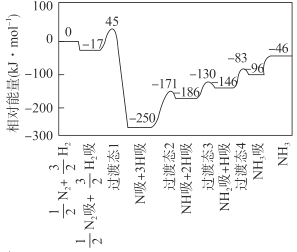
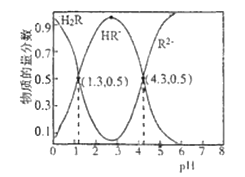
题目内容
【题目】(1)比较结合e-能力的相对强弱:Cl2__________S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱_______。
(2)KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式______。
(3)在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 ____ 。
【答案】> Cl2+ S2-=2Cl-+S↓ ![]() 两者均为分子晶体, 因CBr4的相对分子量大于CCl4,故沸点CBr4较高
两者均为分子晶体, 因CBr4的相对分子量大于CCl4,故沸点CBr4较高
【解析】
(1)元素的非金属性越强,单质的氧化性就越强,结合电子的能力就越强。Cl和S是同周期元素,Cl的原子半径小于S,原子核对核外电子的束缚力Cl强于S,所以Cl的非金属性比S强,所以结合e-能力:Cl>S;氯气能把硫从硫化物中置换出来,根据氧化剂的氧化性强于氧化产物的氧化性,可以说明Cl2比S结合e-能力强:Cl2+ S2-=2Cl-+S↓。
(2)KCN 是离子化合物,是由K+和CN- 构成的,各原子均满足8 电子稳定结构,所以在CN-中,C和N共用三对电子,C得到了K的一个电子,使得K、C、N都满足最外层8电子稳定结构,KCN的电子式为![]() 。
。
(3)对于组成和结构相似的分子晶体来说,相对分子质量越大,分子间作用力越大。CBr4和CCl4均为分子晶体,CBr4的相对分子质量大于CCl4的相对分子质量,所以CBr4的分子间作用力大于CCl4的分子间作用力,导致CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目