题目内容
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
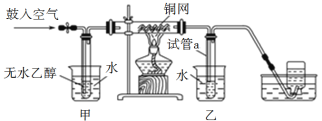
(1)实验过程中铜网出现红色和黑色交替的现象,实际上是发生了两个化学反应,请写出它们的化学方程式_______、______。
(2)甲和乙两个水浴作用不相同。甲的作用是________________,乙的作用是________________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是_______;集气瓶中收集到的气体的主要成分是_______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有________________。要除去该物质,可先在混合液中加入________(填字母),然后再通过蒸馏即可除去。
a 氯化钠溶液 b 苯 c 碳酸氢钠溶液 d 四氯化碳
【答案】2Cu+O2![]() 2CuO CH3CH2OH+CuO
2CuO CH3CH2OH+CuO ![]() CH3CHO+Cu+H2O 加热 冷却 乙醛、乙醇、水 氮气 乙酸 c
CH3CHO+Cu+H2O 加热 冷却 乙醛、乙醇、水 氮气 乙酸 c
【解析】
乙醇和O2在铜作催化剂,加热的条件下发生生成乙醛,首先O2和乙醇混合,则甲装置加热使乙醇挥发,与O2混合;乙装置中加冷水,使产物乙醛冷凝下来,同时冷凝的还有未反应的乙醇。
(1)乙醇的催化氧化实验中,Cu作催化剂,反应过程中,Cu先与氧气反应:2Cu+O2![]() 2CuO,红色变为黑色,然后乙醇与CuO发生:CH3CH2OH+CuO
2CuO,红色变为黑色,然后乙醇与CuO发生:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O,黑色变为红色;
CH3CHO+Cu+H2O,黑色变为红色;
(2)常温下乙醇为液体,在玻璃管中发生乙醇催化氧化,需要将乙醇转化成气体,即甲中水浴加热的目的是将乙醇气化得到稳定的乙醇气流;生成乙醛在加热时为气体,因此乙装置是为了使乙醛更快的冷凝;
(3)反应冷却后,a中收集到的物质有易挥发的乙醇及反应生成的乙醛和水;空气主要成分是N2和O2,因此集气瓶中收集的气体主要为N2;
(4)紫色石蕊试纸显红色,说明液体中含有酸性物质,即部分乙醛被氧化成乙酸;乙酸易挥发,除去乙酸,需要让乙酸转化成高沸点的盐,即加入碳酸氢钠溶液,故选项c正确。

【题目】氮是动植物生长不可缺少的元素,氮在自然界中的循环对生命有重要意义。
(1)合成氨反应为N2(g)+3H2(g)![]() 2 NH3(g) H=-92.3kJ/mol,工业上为了提高H2的转化率可采取的措施是:____________________。
2 NH3(g) H=-92.3kJ/mol,工业上为了提高H2的转化率可采取的措施是:____________________。
A.使用催化剂 B.增大N2浓度 C增大压强 D.升高温度 E.及时分离生成的NH3
(2)氮的氧化物属大气污染物,为变废为宝可将NO和NO2按一定的比例通入NaOH溶液使之恰好完全被吸收生成NaNO2,写出该反应的离子方程式:_______________________________。
(3)NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2 NH3(g)== NH2COONH4(s) H1=-159.5kJ/mol
NH2COONH4(s) == CO(NH2)2(s) + H2O(g) H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)== CO(NH2)2(s) + H2O(g) H=____________kJ/mol
(4)向温度为T容积为1L的刚性密闭容器中通入1molN2和3molH2发生N2(g)+3H2(g)![]() 2NH3(g)的反应。体系总压强p与反应时间t的关系如下表:
2NH3(g)的反应。体系总压强p与反应时间t的关系如下表:
t/h | 0 | 1 | 2 | 4 | 8 | 16 |
p/Mpa | 30.0 | 28.0 | 26.5 | 25.5 | 25.0 | 25.0 |
则H2的平衡转化率α(H2)=_____(保留1位小数),平衡常数K=_____(用分数表示)。
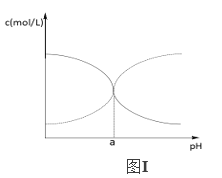
(5)现有25℃时某浓度的氯化铵溶液中NH3H2O和NH4+的浓度随pH的变化示意图如图Ⅰ所示,该温度下NH3H2O电离平衡常数为____________(用a的代数式表示)。
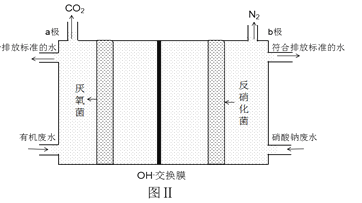
(6)利用微生物的作用将化学能转化为电能即设计成微生物电池可用于同时处理含硝酸钠和有机物的废水,使NO3- 转化为N2,装置原理如图Ⅱ(图中有机物用C6H12O6表示)。写出电极b上发生的电极反应式:_________________________________________。
【题目】(1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l) ![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色。
往上述溶液中加入氢氧化钠溶液呈_______色,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压强或温度),平衡就会向着_________这种改变的方向移动;
(2)在KMnO4与H2C2O4反应中,可通过测定_________________的时间来测定该反应的速率;
此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)。
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①淀粉溶液的作用是__________________________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,
试推测该实验结论: ____________________________________________________。