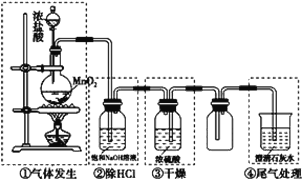
题目内容
【题目】下列有关电解质溶液的叙述正确的是
A. 室温时,Ka=1×10-5浓度为0.1mol/L 的HA 溶液,pH=3
B. 向0.10mol·L-1NH4HCO3溶液中通CO2至溶液pH=7:c(NH4+)=c(HCO3-)+c(CO32-)
C. 在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液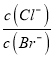 增大
增大
D. 25℃时,向20mL0.01mol/L的醋酸溶液中滴加10mL0.01mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)3COOH)+c(OH-)
【答案】A
【解析】A、Ka=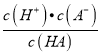 =
=![]() =1×10-5,所以c(H+)=10-3mol/L,则pH≈3,故A正确;B. 向0.10mol/LNH4HCO3溶液中通CO2至溶液pH=7,c(H+)=c(OH-),根据电荷守恒,c(NH4+)+ c(H+) =c(HCO3-)+2c(CO32-)+c(OH-),因此c(NH4+)=c(HCO3-)+2c(CO32-),故B错误;C、在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液
=1×10-5,所以c(H+)=10-3mol/L,则pH≈3,故A正确;B. 向0.10mol/LNH4HCO3溶液中通CO2至溶液pH=7,c(H+)=c(OH-),根据电荷守恒,c(NH4+)+ c(H+) =c(HCO3-)+2c(CO32-)+c(OH-),因此c(NH4+)=c(HCO3-)+2c(CO32-),故B错误;C、在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液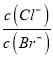 =
=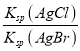 ,而温度不变容度积不变,所以
,而温度不变容度积不变,所以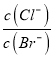 不变,故C错误;D、向20 mL 0.01 mol/L的醋酸溶液中滴加10 mL 0.01 mol/L的KOH溶液生成物质的量相等的醋酸和醋酸钾的混合溶液,根据电荷守恒可知:c(K+)+c(H+)=c(CH3COO-)+c(OH-),而溶液呈酸性说明CH3COOH的电离程度大于醋酸根的水解程度,则c(CH3COOH)<c(CH3COO-),所以c(K+)+c(H+)>c(CH3COOH)+c(OH-),故D错误;故选A。
不变,故C错误;D、向20 mL 0.01 mol/L的醋酸溶液中滴加10 mL 0.01 mol/L的KOH溶液生成物质的量相等的醋酸和醋酸钾的混合溶液,根据电荷守恒可知:c(K+)+c(H+)=c(CH3COO-)+c(OH-),而溶液呈酸性说明CH3COOH的电离程度大于醋酸根的水解程度,则c(CH3COOH)<c(CH3COO-),所以c(K+)+c(H+)>c(CH3COOH)+c(OH-),故D错误;故选A。

【题目】常见的分类法有交叉分类法、树状分类法等。无机化合物可根据其组成和性质进行分类:
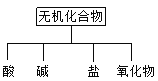
(1)上图所示的物质分类方法名称是_______________________。
(2)以Na、H、O、N、C中两种或三种元素组成合适的物质,分别填在下表①④⑦处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ① _________②HNO3 | ③NH3H2O ④________ | ⑤Na2CO3 ⑥NaNO3 ⑦_______ | ⑧CO2 ⑨Na2O2 |
(3)在②③⑤⑥⑧⑨六种物质中,属于非电解质的是______________(填序号)。
(4)过量⑧通入④中发生反应的离子方程式为:______________________________________________。⑧与⑨反应的化学方程式为:______________________________。
(5)15.9g⑤溶于水配制成250mL溶液,CO32-的粒子数为__________,Na+的物质的量浓度为________。