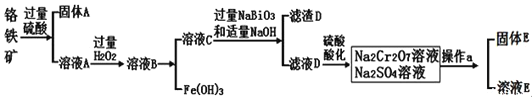
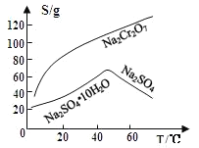
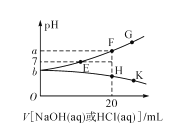
题目内容
【题目】水的电离过程为H2O![]() OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
A.在35℃,纯水中C(H+)>C(OH-)
B.水的电离度α(25℃)>α(35℃)
C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
D.某温度下纯水中C(H+) 为2×10-7mol/L,则此时的C(OH-) 也为2×10-7mol/L
【答案】D
【解析】
A.纯水中c(H+)=c(OH-) ,故A不选;
B. 因为水的电离吸热,温度升高,水的离子积变大,电离度也变大,故B不选;
C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,但是温度不变,水的离子积不变,故C不选;
D.某温度下纯水中c(H+)=c(OH-) =2×10-7mol/L,D正确。
故选D。

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目