题目内容
【题目】25 ℃时,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。下列说法错误的是( )
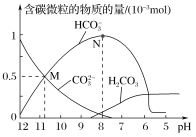
A.HCl溶液滴加一半时,溶液pH>7
B.H2CO3的Ka1的数量级为10-6
C.pH=8时,溶液中NaHCO3的物质的量浓度为0.1 mol·L-1
D.在M点:c(Na+)>c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
【答案】C
【解析】
不加酸时,Na2CO3溶液显碱性,随着HCl溶液的加入,溶液由碳酸钠转变为碳酸氢钠,当HCl溶液滴加一半时,两者恰好生成碳酸氢钠,再继续加HCl溶液,溶液逐步由碳酸氢钠转化为碳酸,由此分析。
A.当HCl溶液滴加一半时,两者恰好生成碳酸氢钠,溶液中,以NaHCO3为主,故该溶液呈碱性,溶液pH>7,故A正确;
B.由图中可以看出,当c(H+)=106mol/L时,c(H2CO3)=c(HCO![]() ),H2CO3的Ka1=
),H2CO3的Ka1=![]() ,故B正确;
,故B正确;
C.从图中可知当pH值为8时,溶液中的主要溶质为NaHCO3。当加入盐酸的体积为10mL时,恰好生成NaHCO3,此时NaHCO3的物质的量浓度为0.05mol/L,故C错误;
D.由图可知M点的CO32-和HCO3-物质的量相等,两者的盐水解溶液呈碱性,pH值为11呈碱性,故离子浓度为:c(Na+)>c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+),故D正确;
)>c(OH-)>c(H+),故D正确;
答案选C。

练习册系列答案
相关题目