题目内容
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)现有反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
①如果上述反应的平衡常数K值变大,该反应___(填字母)。
a.一定向正反应方向移动 b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动过程中逆反应速率先减小后增大
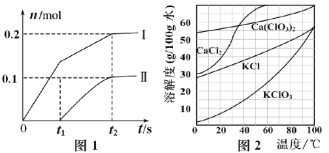
②若反应容器的容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为___。
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反应向___(填“正反应”或“逆反应”)方向进行。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
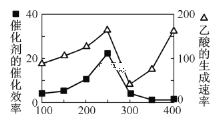
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___。
②为了提高该反应中CO2的转化率,可以采取的措施是___。(写一条即可)
【答案】ad 0.05mol·L-1·min-1 逆反应 温度超过250℃,催化剂的催化效率降低 增大反应压强(或增大CH4的浓度)
【解析】
(1)①如果反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0的平衡常数K值变大,说明降低温度;
CH3OH(g)+H2O(g) ΔH<0的平衡常数K值变大,说明降低温度;
②根据差量法、结合化学反应速率的公式进行计算;
③根据浓度商与K的大小进行判断;
(2)①先弄清两条曲线的含义,这里涉及到影响反应速率的两个因素:催化剂和温度,从图像上看出100~250 ℃,温度升高,催化效率提高,而250~300 ℃,升高温度,催化效率下降,因而乙酸的生成速率下降;
②利用平衡原理进行分析。
(1)①如果反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0的平衡常数K值变大,说明降低温度,
CH3OH(g)+H2O(g) ΔH<0的平衡常数K值变大,说明降低温度,
a.降低温度,平衡一定向着正向移动,选项a正确;
b.降低温度后,正逆反应速率都减小,正反应速率在达到平衡前始终在减小,选项b错误;
c.降低温度,平衡一定向着正向移动,选项c错误;
d.化学平衡常数变大,说明降低温度,则正逆反应速率都减小,由于平衡向着正向移动,则逆反应速率先减小后增大,选项d正确;
答案选ad;
②若反应的容器容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 气体减少的物质的量△n
CH3OH(g)+H2O(g) 气体减少的物质的量△n
1mol 2mol
n 0.8mol
反应消耗的二氧化碳的物质的量为:n=![]() =0.4mol,
=0.4mol,
在4min内CO2的平均反应速率为: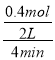 =0.05 mol·L-1·min-1;
=0.05 mol·L-1·min-1;
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),Qc=![]() =1.67>K=1,故反应向逆反应方向进行;
=1.67>K=1,故反应向逆反应方向进行;
(2)①由于催化剂的催化效率受温度影响大,根据图像,250~300℃时,温度升高而乙酸的生成速率降低的原因是:温度超过250℃时,催化剂的催化效率降低;
②该反应的正反应是体积减小的可逆反应,所以为了提高该反应中CO2的转化率,可以采取的措施是增大反应压强或增大CH4的浓度。