题目内容
【题目】25℃时,取浓度均为0.1000molL-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000molL-1NaOH溶液、0.1000molL-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法不正确的是( )
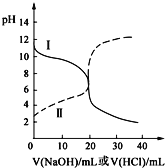
A. 根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3H2O)≈10-5
B. 当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
C. 曲线I表示的滴定过程一般选择甲基橙作指示剂
D. 在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
【答案】B
【解析】
I曲线开始点为碱性,说明用盐酸滴定氨水,Ⅱ曲线为NaOH滴定醋酸溶液,然后逐步分析;
A、I曲线的起点为碱性,说明用盐酸滴定氨水,开始时氨水的pH约为11,即溶液中c(OH-)=10-3mol·L-1,则氨水的电离平衡常数Kb=![]() 1×10-5,Ⅱ曲线的起点为酸性,用氢氧化钠滴定醋酸,开始时醋酸的pH约为3,同理得到Ka=1×10-5,故A说法正确;
1×10-5,Ⅱ曲线的起点为酸性,用氢氧化钠滴定醋酸,开始时醋酸的pH约为3,同理得到Ka=1×10-5,故A说法正确;
B、当NaOH溶液和盐酸滴加至20mL,氢氧化钠与醋酸反应生成CH3COONa,溶液显碱性,溶液的pH>7;盐酸与氨水反应生成氯化铵,溶液显酸性,溶液的pH<7,因此曲线I和Ⅱ一定不会相交,故B说法错误;
C、根据选项B的分析,滴定到终点时,溶液显酸性,因此选用甲基橙为指示剂,故C说法正确;
D、酸和碱对水的电离起到抑制作用,在逐滴加入NaOH或盐酸过程中,溶液的碱性或酸性逐步降低,水的电离程度逐渐增大,当恰好完全反应时,水的电离程度达到最大,之后继续滴入NaOH或盐酸,溶液的碱性或酸性逐渐增强,水的电离程度逐渐减小,故D说法正确;
答案选B。

练习册系列答案
相关题目