题目内容
【题目】(一)室温下,在25 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,曲线如下图所示,回答下列问题:

(1)写出CH3COOH的电离方程式__________________________。
(2)下列说法不正确的是___________________。
A. 0.1 mol/L CH3COOH溶液中, CH3COOH电离度约为1%
B. B点满足: c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+)
C. C点时的离子浓度关系为:c(CH3COO-)= c(Na+)> c(H+)= c(OH-)
D. D点时的离子浓度关系为: c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
(3)室温下,试计算CH3COOH电离平衡常数为____________(用含b的表达式表示)。
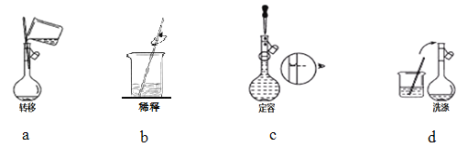
(二)实验室为测定食醋中CH3COOH的浓度,取25mL食醋置于250mL容量瓶中,加水稀释至刻度并摇匀。用酸式滴定管量取25.00mL稀释后的醋酸溶液放入锥形瓶中,加指示剂,然后用0.1000 mol·L-1NaOH标准溶液进行滴定。
(4)指示剂应为________。
A.甲基橙 B.甲基红 C.酚酞 D.石蕊
(5)滴定终点的判断方法为____________________________________________________。
(6)为提高测定的准确度,重复上述实验三次,0.1000 mol·L-1NaOH标准溶液滴定前后的读数如下表所示,则该食醋中CH3COOH的浓度为_________mol·L-1。
实验次数 | 稀释后的醋酸溶液体积/ mL | NaOH滴定前读数/ mL | NaOH滴定后读数/ mL |
第1次 | 25.00 | 0.10 | 24.00 |
第2次 | 25.00 | 0.50 | 22.50 |
第3次 | 25.00 | 0.20 | 24.30 |
(7)用0.1000 mol·L-1NaOH标准溶液进行滴定,下列操作会导致测定结果偏高的是_______。
A.碱式滴定管内滴定后产生气泡
B.读取标准液读数时,滴定前俯视,滴定到终点后仰视
C.配制0.1000 mol·L-1NaOH溶液时,固体NaOH中含有结晶水
D.碱式滴定管未润洗就装入标准液进行滴定
【答案】CH3COOH![]() CH3COO - +H+ BD 10-7b/(25-b) C 当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色 0.9600 BCD
CH3COO - +H+ BD 10-7b/(25-b) C 当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色 0.9600 BCD
【解析】
(1)醋酸是弱酸,电离方程式为:CH3COOH![]() CH3COO - +H+。
CH3COO - +H+。
(2)根据电荷守恒和物料守恒推导。
(3)溶液的PH=7,根据电荷守恒,c(CH3COO-)= c(Na+)=b×10-4 mol·L-1,根据物料守恒,c(CH3COOH)=25×10-4- b×10-4,K= c(CH3COO-) c(H+)/ c(CH3COOH)= b×10-4×10-7/(25-b)×10-4=10-7b/(25-b)。
(4)用氢氧化钠滴定醋酸,在滴定终点得到的是醋酸钠溶液,溶液呈弱碱性,所以要选用酚酞作指示剂。
(5)滴定终点的判断方法为:当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色。
(6)第2组数据无效,根据NaOH+CH3COOH=CH3COONa+H2O可知消耗NaOH的物质的量和CH3COOH的物质的量相等来计算。
(7)根据c(待测)= c(标准)×V(标准)/ V(待测)推导。
(1)醋酸是弱酸,电离方程式为:CH3COOH![]() CH3COO - +H+ ,故答案为:CH3COOH
CH3COO - +H+ ,故答案为:CH3COOH![]() CH3COO - +H+ 。
CH3COO - +H+ 。
(2)A.由图可知,滴定前0.1 mol·L-1 CH3COOH溶液的PH值为3,电离度为(10-3/0.1)×100% ≈1%;故A正确;
B.B点得到等物质的量的CH3COOH和CH3COONa的混合溶液,根据电荷守恒得c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),根据物料守恒得2c(Na+)= c(CH3COO-)+ c(CH3COOH),整理以上两个式子得质子守恒式c(CH3COO-)+2c(OH-)= c(CH3COOH)+ 2c(H+),故B错误;
C. C点溶液的PH=7,c(H+)= c(OH-),根据电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)得c(CH3COO-)= c(Na+),c(H+)、c(OH-)小于c(CH3COO-)、 c(Na+),故C正确;
D. D点得到的是等物质的量NaOH和CH3COONa的混合溶液,因CH3COO-要水解,故离子浓度大小关系c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误。
故选BD。
(3)溶液的PH=7,根据电荷守恒,c(CH3COO-)= c(Na+)=b×10-4 mol·L-1,根据物料守恒,c(CH3COOH)=25×10-4- b×10-4,K= c(CH3COO-) c(H+)/ c(CH3COOH)= b×10-4×10-7/(25-b)×10-4=10-7b/(25-b),故答案为:10-7b/(25-b)。
(4)用氢氧化钠滴定醋酸,在滴定终点得到的是醋酸钠溶液,溶液呈弱碱性,所以要选用酚酞作指示剂,故选C。
(5)滴定终点的判断方法为:当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色,故答案为:当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色。
(6)NaOH+CH3COOH=CH3COONa+H2O,第1次消耗NaOH溶液的体积是23.9 mL, 第2次消耗NaOH溶液的体积是22.0 mL,第3次消耗NaOH溶液的体积是24.1mL,第2组数据无效,两次平均值为:24.0 mL,根据反应方程式可知消耗NaOH的物质的量和CH3COOH的物质的量相等,消耗NaOH的物质的量为2.4×10-3 mol,所以CH3COOH的浓度为2.4×10-3 mol/25.00×10-3L=0.096 mol·L-1, 实验室为测定食醋中CH3COOH的浓度,取25mL食醋置于250mL容量瓶中,加水稀释至刻度并摇匀,所以该食醋中CH3COOH的浓度为0.9600mol·L-1。故答案为:0.9600。
(7)根据c(待测)= c(标准)×V(标准)/ V(待测)推导
A. 碱式滴定管内滴定后产生气泡,导致消耗标准溶液体积偏小,测定结果偏小,故A错误;
B. 读取标准液读数时,滴定前俯视,滴定到终点后仰视,导致消耗标准溶液体积偏大,测定结果偏大,故B正确;
C. 配制0.1000 mol·L-1NaOH溶液时,固体NaOH中含有结晶水,所配溶液浓度小于0.1000 mol·L-1,导致消耗标准溶液体积偏大,故测定结果偏高,故C正确;
D. 碱式滴定管未润洗就装入标准液进行滴定,造成消耗的V(标准)偏大,故测定结果偏高,故D正确。
故选BCD。