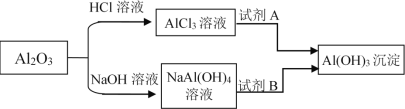
题目内容
【题目】把0.1 molMnO2粉末加入50 mL过氧化氢的溶液里(密度为1.1 g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
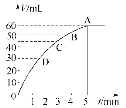
(1)实验时放出气体的体积为__________。
(2)放出一半气体所需的时间约为____________。
(3)根据曲线形状解释反应速率变化的原因________________________。
【答案】60 mL 2 min 随着过氧化氢浓度的减小,化学反应速率减小
【解析】
(1)反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,根据图象可知生成的氧气的体积;
2H2O+O2↑,该反应为不可逆反应,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)根据影响化学反应速率的因素进行分析解答。
(1)由反应方程式2H2O2![]() 2H2O+O2↑可知,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,故答案为:60mL;
2H2O+O2↑可知,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,故答案为:60mL;
(2)由图象可知,当时间进行到约为2min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为2min,故答案为:2min;
(3) 浓度越大,反应速率越大,反之越小,随着反应进行,过氧化氢的浓度逐渐减小,则速率逐渐减小,故答案为:随着过氧化氢浓度的减小,化学反应速率减小。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。