题目内容
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH![]() CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。
请你回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是___________________。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是________,它与溴水反应的化学方程式是_________________。在验证过程中必须全部除去。为此,乙同学设计了如图所示的实验装置:
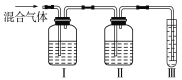
请回答:Ⅰ、Ⅱ、Ⅲ装置中可盛放的试剂是:Ⅰ________、Ⅱ________、Ⅲ________(填序号)。
A.品红 B.NaOH溶液
C.溴水 D.酸性高锰酸钾溶液
(3)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是____________。
【答案】不能 AC SO2 SO2+Br2+2H2O═2HBr+H2SO4 B A C 乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性
【解析】
用乙醇和浓硫酸为原料制取的乙烯内可能含有SO2气体,因SO2能将溴水还原而使之褪色,故溴水褪色不能证明是乙烯与溴水发生了加成反应;乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性。
(1)用此法得到的乙烯内可能含有SO2气体,因SO2能将溴水还原而使之褪色,故溴水褪色不能证明是乙烯与溴水发生了加成反应。
(2)综上分析,乙烯中可能含有的一种杂质气体是SO2,它与溴水发生反应的化学方程式是SO2+Br2+2H2O═2HBr+H2SO4;为除去乙烯中的SO2,选择能与SO2反应但不能与乙烯反应的试剂,溴水、酸性高锰酸钾溶液均能与乙烯反应,故装置Ⅰ中盛放的试剂为NaOH溶液,SO2与NaOH溶液反应后需检验SO2是否除尽,则装置Ⅱ盛放品红验证O2是否除尽;装置Ⅲ用来证明乙烯与溴水发生了反应,则装置Ⅲ盛放的是溴水。
(3)乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性,故可用pH试纸来测试反应后溶液的酸性验证这一反应是加成反应而不是取代反应。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案