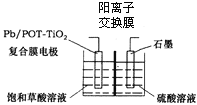
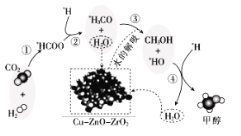
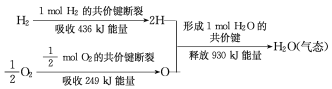
��Ŀ����
����Ŀ��1.52 gͭþ�Ͻ���ȫ�ܽ���50 mL�ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120 mL(��״��)����Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54 g����������˵������ȷ���ǣ� ��
A. �úϽ���ͭ��þ�����ʵ���֮����2��1
B. NO2��N2O4�Ļ�������У�NO2�����������80%
C. ��Ũ������HNO3�����ʵ���Ũ����14.0 mol/L
D. �õ�2.54 g����ʱ������NaOH��Һ�������600 mL
���𰸡�D
��������
A����������ȫ������ʱ���õ�2.54g����Ϊ������ͭ��������þ���ʳ�����������������Ϊ2.54g-1.52g=1.02g�������������ʵ���Ϊ![]() =0.06mol�����ݵ���غ��֪�������ṩ�ĵ������ʵ������������������ʵ�������ͭ��þ�Ͻ���Cu��Mg�����ʵ����ֱ�Ϊxmol��ymol����2x+2y=0.06��64x+24y=1.52�����x=0.02��y=0.01���ʺϽ���ͭ��þ�����ʵ���֮���ǣ�2��1����A��ȷ��
=0.06mol�����ݵ���غ��֪�������ṩ�ĵ������ʵ������������������ʵ�������ͭ��þ�Ͻ���Cu��Mg�����ʵ����ֱ�Ϊxmol��ymol����2x+2y=0.06��64x+24y=1.52�����x=0.02��y=0.01���ʺϽ���ͭ��þ�����ʵ���֮���ǣ�2��1����A��ȷ��
B������£�NO2��N2O4�����������ʵ���Ϊ��![]() =0.05mol����������������ʵ���Ϊamol�������������������ʵ���Ϊ(0.05-a)mol�����ݵ���ת���غ��֪��a��1+(0.05-a)��2��1=0.06����ã�a=0.04��NO2���������Ϊ
=0.05mol����������������ʵ���Ϊamol�������������������ʵ���Ϊ(0.05-a)mol�����ݵ���ת���غ��֪��a��1+(0.05-a)��2��1=0.06����ã�a=0.04��NO2���������Ϊ![]() ��100%=80%����B��ȷ��
��100%=80%����B��ȷ��
C����Ũ�����ܶ�Ϊ1.40g/mL����������Ϊ63%�����Ũ��������ʵ���Ũ��Ϊ��![]() mol/L=14.0mol/L����C��ȷ��
mol/L=14.0mol/L����C��ȷ��
D����������ȫ������ʱ����Ӧ������Ϊ�����ƣ����ݵ�Ԫ���غ��֪�������Ƶ����ʵ���Ϊ0.05L��14mol/L-0.04mol-(0.05-0.04)mol��2=0.64mol�������������غ��֪n(NaOH)=n(NaNO3)=0.64mol������Ҫ����������Һ�����Ϊ��![]() =0.64L=640mL����D����
=0.64L=640mL����D����
�ʴ�ΪD��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʵ���������������ý��۶���ȷ����
ѡ�� | ʵ�� | ���� | ���� |
A | ����з�̪�� Na2CO3 ��Һ�м��������Ȼ������壬�� | ��Һ��ɫ��dz | Na2CO3��Һ����ˮ��ƽ�� |
B | ��X��Һ�еμӼ���������ˮ���� �� ���ټ�������KSCN��Һ | ��Һ��Ϊ��ɫ | X��Һ��һ������Fe2+ |
C | ����ʳ���Ƿ�ӵ⣨ KIO3���� ȡ����ʳ������ˮ���õ��۵⻯����ֽ���� | ��ֽ������ | ��ʳ�β�����KIO3 |
D | ������Һ�м���CuSO4��( NH4)2 SO4 �ı�����Һ | ���г������� | �����ʾ����������� |
A.AB.BC.CD.D