题目内容
【题目】草酸(![]() )广泛存在于食品中,人们对其及相关产品进行了深入研究。
)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1) ![]() (s)═
(s)═ ![]() O(g)+CO(g)+C
O(g)+CO(g)+C![]() (g)△H=+340kJmo
(g)△H=+340kJmo![]() 在密闭容器中反应,保持温度不变,下列有关选项正确的是_____(填序号)
在密闭容器中反应,保持温度不变,下列有关选项正确的是_____(填序号)
A 恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态
B 恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态
C 气体摩尔体积不再发生变化,说明该反应已达到化学平衡状态
D 气体平均摩尔质量不再发生变化,说明该反应已达到化学平衡状态
E 气体总质量不再发生变化,说明该反应已达到化学平衡状态
(2)草酸分解所需燃料可以是CO,通过甲烷制备CO:C![]() (g)+C
(g)+C![]() (g)→2CO(g)+2
(g)→2CO(g)+2![]() (g)△H>O.常温下,在2L的密闭容器中通入4molC
(g)△H>O.常温下,在2L的密闭容器中通入4molC![]() 气体和6molC
气体和6molC![]() 气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1mol
气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1mol![]() 。
。
①平衡时,该反应的平均反应速率v(C![]() )=_____mol
)=_____mol![]() mi
mi![]() 。
。
②在不改变反应混合物用量的前提下,为了提高C![]() 气体的转化率,可采取的措施是_____。(答出一方面即可)
气体的转化率,可采取的措施是_____。(答出一方面即可)
(3)草酸(![]() )是二元弱酸,KH
)是二元弱酸,KH![]() 溶液呈酸性。向10mL 0.01mol
溶液呈酸性。向10mL 0.01mol![]() 的
的![]() 溶液滴加0.01mol
溶液滴加0.01mol![]() KOH溶液V(mL),回答下列问题。
KOH溶液V(mL),回答下列问题。
①当V=10mL时,溶液中H![]() 、
、![]() 、
、![]() 、
、![]() 的浓度从大到小的顺序为_____。
的浓度从大到小的顺序为_____。
② 当V=a mL时,溶液中离子浓度有如下关系:c(![]() )=2c(
)=2c(![]() )+c(H
)+c(H![]() );当V=b mL时,溶液中离子浓度有如下关系:c(
);当V=b mL时,溶液中离子浓度有如下关系:c(![]() )=c(
)=c(![]() )+c(H
)+c(H![]() )+c(
)+c(![]() );则a_____b(填“<”,“=”或“>”)。
);则a_____b(填“<”,“=”或“>”)。
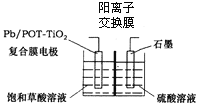
(4)电解饱和草酸溶液可以制得高档香料乙醛酸(![]() ),装置如图所示,写出复合膜电极的电极反应式_____。
),装置如图所示,写出复合膜电极的电极反应式_____。
【答案】ABE 0.01 升高温度或增大容器的体积(减小压强) c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4) > H2C2O4 + 2H+ + 2e- ═ H2C2O3+H2O
【解析】
(1)反应H2C2O4 (s)═ H2O(g)+CO(g)+CO2(g) △H=+340kJmol-1的平衡,密闭容器中,保持温度不变,
A.反应H2C2O4 (s)═ H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态,故A正确;
B.反应H2C2O4 (s)═ H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态,故B正确;
C.一定条件下气体摩尔体积是不变的,当气体摩尔体积不再发生变化,不能说明该反应已达到化学平衡状态,故C错误;
D.生成物气体是按照固定比例生成的,气体平均摩尔质量不发生变化,所以气体平均摩尔质量不再发生变化,不能说明该反应已达到化学平衡状态,故D错误;
E.气体总质量不再发生变化,可知气体的物质的量不变,说明该反应已达到化学平衡状态,故E正确;
故答案为:ABE;
(2) CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始量(mol) 4 6 0 0
变化量(mol) 0.1×1 0.1×1 0.1×2 0.1×2
平衡量(mol) 3.9 5.9 0.1×2 0.1×2
①平衡时,该反应的平均反应速率v(CO2)=![]() =
=![]() =0.01 molL-1min-1,
=0.01 molL-1min-1,
故答案为:0.01;
②反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g) ![]() H>0,正反应为吸热反应,且是一个气体体积增大的反应,故升高温度或增大容器的体积(减小压强)平衡右移,CH4气体的转化率升高,
H>0,正反应为吸热反应,且是一个气体体积增大的反应,故升高温度或增大容器的体积(减小压强)平衡右移,CH4气体的转化率升高,
故答案为:升高温度或增大容器的体积(减小压强);
(3) ①向10mL 0.01molL-1的H2C2O4溶液滴加0.01molL-1KOH溶液,当V=10mL时,草酸与氢氧化钾恰好反应生成草酸氢钾,由于草酸氢钾溶液显示酸性,则H2C2O4的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的电离和水解程度都较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4) ,
故答案为:c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4);
②c(K+)=2c(C2O42-)+c(HC2O4-),根据电荷守恒c(K+)+ c(H+)= 2c(C2O42-)+c(HC2O4-)+ c(OH-)可得 c(H+)= c(OH-)所以溶液呈中性,pH=7,草酸氢钾溶液呈酸性,要使溶液呈中性,则氢氧化钾应该稍微过量,所以V(KOH)=a>10mL;溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+ c(H2C2O4),根据溶液中物料守恒分析,溶质为KHC2O4,说明V(KOH)=b=10mL,则a>b,
故答案为:>;
(4)惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为H2C2O4 + 2H+ + 2e- = H2C2O3+H2O,
故答案为:H2C2O4 + 2H+ + 2e- ═ H2C2O3+H2O。

【题目】Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
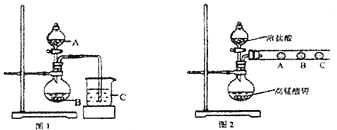
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象
A. ;B. ;C. 。
从环保角度考虑,该装置有明显不足,请指出提出改进建议 。
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 |
|
|
2 |
|
|
请根据以上信息简要解释溶解阳极泥不用王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。
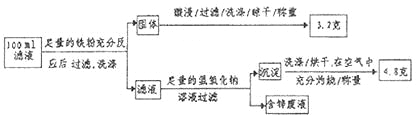
则![]() 滤液中
滤液中![]() 的浓度为
的浓度为 ![]() ,
,![]() 的浓度为
的浓度为 ![]() 。
。