题目内容
【题目】氢气是未来最理想的能源,最近科学家研制出利用太阳能产生激光,在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
(1)太阳光分解海水时,实现了_____能转变为_______能,二氧化钛作_______。生成的氢气用于燃料电池时,实现了_______能转变为_______能。太阳光分解海水的反应属于_______(填“放热”或“吸热”)反应。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)请根据下列信息,写出H2燃烧热的热化学方程式________。
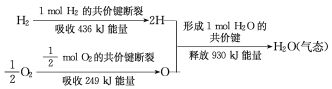
H2O(l) = H2O(g) ΔH = +44kJ/mol
【答案】太阳 化学 催化剂 化学 电 吸热 负 流出 H2(g) +![]() O2(g) = H2O(l) ΔH = -289kJ/mol
O2(g) = H2O(l) ΔH = -289kJ/mol
【解析】
(1)水在催化剂和激光条件下分解,属于吸热反应,
(2)根据原电池原理分析,负极发生氧化反应,正极发生还原反应,电流从正极流出,电子的方向与电流相反;
(3)由燃烧热的定义及盖斯定律书写;
(1) 科学家利用太阳能在催化剂(二氧化钛)作用下,使海水分解生成氢气和氧气,在这个过程中太阳能转变为化学能,生成的氢气用于燃料电池时,是把化学能转变为电能,氢气在氧气中燃烧是放热反应,水分解为氧气和氢气是吸热反应;答案是:太阳; 化学; 催化剂 ;化学; 电;吸热;
(2)氢氧燃料电池工作时, 氢气在负极发生氧化反应,氧气在正极发生还原反应,A极反应为2H2+2O2--4e-=2H2O,氢气失去电子发生氧化反应,所以A极是负极,原电池中电流从正极流出,电子的流向与电流方向相反,所以电子从负极流出,即电子从A极流出,答案为:负;流出;
(3) ΔH=反应物的键能总和—生成物的键能总和,由信息可知反应①H2(g)+![]() O2(g)=H2O(g)的ΔH=(436+249-930) kJ/mol=-245 kJ/mol,又知反应②H2O(l) = H2O(g) ΔH = +44kJ/mol,H2的燃烧热是指1mol H2完全燃烧生成稳定的氧化物即液态水所放出的热量,根据盖斯定律,用反应①-②可得到:H2(g) +
O2(g)=H2O(g)的ΔH=(436+249-930) kJ/mol=-245 kJ/mol,又知反应②H2O(l) = H2O(g) ΔH = +44kJ/mol,H2的燃烧热是指1mol H2完全燃烧生成稳定的氧化物即液态水所放出的热量,根据盖斯定律,用反应①-②可得到:H2(g) +![]() O2(g) = H2O(l) ΔH =(-245-44) kJ/mol= -289kJ/mol,答案为:H2(g) +
O2(g) = H2O(l) ΔH =(-245-44) kJ/mol= -289kJ/mol,答案为:H2(g) +![]() O2(g) = H2O(l) ΔH = -289kJ/mol。
O2(g) = H2O(l) ΔH = -289kJ/mol。