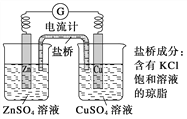
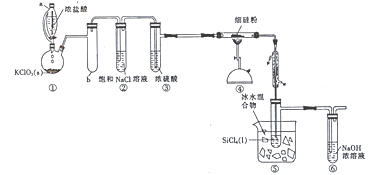
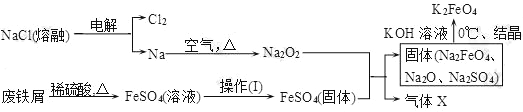
题目内容
【题目】利用碳酸钠晶体(Na2CO3·10H2O,相对分子质量286)来配制0.1mol/L的碳酸钠溶液980mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是
A. 称取碳酸钠晶体28.6g
B. 溶解时进行加热,并将热溶液转移到容量瓶中至刻度线
C. 转移时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤
D. 定容后,将容量瓶振荡摇匀,静置发现液面低于刻度线,又加入少量水至刻度线
【答案】B
【解析】
A.在实验室没有980mL容量瓶,要选择1000mL容量瓶,需要溶质的物质的量为n(Na2CO3)=0.1mol/L×1L=0.1mol,根据n(Na2CO3·10H2O)=n(Na2CO3),所以m(Na2CO3·10H2O)= 0.1mol×286g/mol=28.6g,溶液浓度为0.1mol/L,不会产生误差,A不符合题意;
B.溶解时进行加热,并将热溶液转移到容量瓶中至刻度线,由于溶液的体积受热膨胀,遇冷收缩,所以待恢复至室温时,体积不到1L,根据c=![]() ,可知V偏小,则c偏高,B符合题意;
,可知V偏小,则c偏高,B符合题意;
C.转移时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤,则溶质的物质的量偏少,根据c=![]() ,可知n偏小,则c偏低,C不符合题意;
,可知n偏小,则c偏低,C不符合题意;
D.定容后,将容量瓶振荡摇匀,静置,发现液面低于刻度线,是由于部分溶液粘在容量瓶颈部,若又加入少量水至刻度线,则V偏大,根据c=![]() ,可知:若V偏大,会导致配制溶液的浓度偏低,D不符合题意;
,可知:若V偏大,会导致配制溶液的浓度偏低,D不符合题意;
故合理选项是B。

【题目】I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①已知反应①中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
②请写出CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式:____________________该反应的平衡常数K3=_______________ 。 (反应①和反应②对应的平衡常数为K1和K2)
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)如图所示表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=_____。

(4)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变