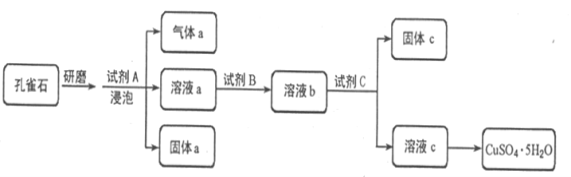
题目内容
【题目】有8种短周期元素,随着原子序数的递增(横坐标),其原子半径相对大小、最高正价或最低负价的变化情况如图所示。
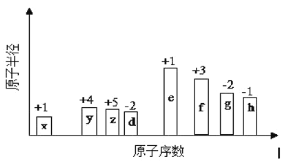
(1)元素h在周期表中的位置是____________。
(2)元素x和y形成的最简单化合物在家庭生活中的用途是____________。
(3)元素e、f最高价氧化物对应水化物的碱性强的是____________。(写化学式)
(4)元素z、x可形成原子个数比为1﹕3的化合物,其电子式为____________。
【答案】第三周期ⅦA族 燃料(或燃气、热源等符合题意的均可) NaOH ![]()
【解析】
从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此分析。
(1) h是Cl元素,在周期表中的位置是第三周期ⅦA族;
(2)元素x和y形成的最简单化合物是甲烷,是天然气的主要成分,在家庭生活中的用途是燃料(或燃气、热源);
(3)元素e、f最高价氧化物对应水化物分别是氢氧化钠和氢氧化铝,钠和铝位于同一周期,钠的金属性强于铝,金属性越强,元素的最高价氧化物对应的水化物碱性越强,碱性强的是NaOH;
(4)元素z、x可形成原子个数比为1﹕3的化合物是氨气,其电子式为![]() 。
。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目