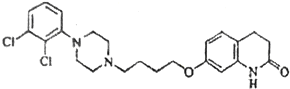
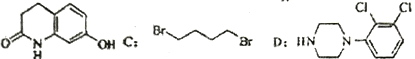
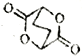
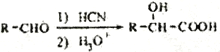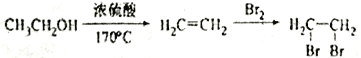题目内容
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水,如下图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味。这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)。实验中的下列结论正确的是( )

A. 自发反应一定是放热反应
B. 自发反应一定是吸热反应
C. 有的吸热反应也能自发进行
D. 吸热反应不能自发进行
【答案】C
【解析】焓变小于0利于自发;熵变大于0利于自发;判断某一反应能否自发不能孤立的看焓判据或熵判据,要综合这两个判据,即根据自由能变判断:△G=△H+T△S;若△G<0反应一定能自发;若△G>0反应一定不能自发;

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
(1)用催化技术将汽车尾气中的NO和CO转变成CO2和N2,反应原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
某温度下测得该反应在不同时间的CO浓度如下表:
时间(s) 浓度 ×10-3(molL-1) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
该反应平衡常数K的表达式____________________;温度升高,K值___________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=_______________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_________。
(2)工业合成氨的反应温度选择500℃左右的主要原因是______________________。
(3)在固定容积的密闭容器中,加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是__________________________________________________。
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液呈现酸性的原因________________________________(用离子方程式表示);在通入NH3的过程中溶液的导电能力______(选填“变大”、“变小”、“几乎不变”)。