题目内容
【题目】丁二酮肟可用于镍的检验和测定,其结构式如图:
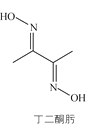
(1)Ni元素基态原子价电子排布式为________,C、N、O第一电离能由大到小的顺序是________。
(2)1mol丁二酮肟含有的σ键数目是________,碳原子的杂化方式为________。
(3)丁二酮肟镍分子内含有的作用力有________(填字母)。
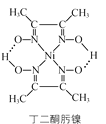
a.配位键 b. 离子键 c. 氢键 d. 范德华力
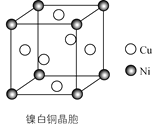
(4)某镍白铜的晶胞如图所示,其化学式为________。
【答案】3d84s2 N>O>C 15 mol sp2和sp3 ac Cu3Ni
【解析】
(1)Ni为第27号元素,其基态价电子排布式为3d84s2;第一电离能总的趋势为同一周期从左向右一次递增,但由于第二、五主族在电子排布时特使,是第二、五主族的元素的电离能较相邻两个主族元素的第一电离能大些,故C、N、O三种元素的第一电离能大小从大到小为N>O>C;
(2)根据丁二酮肟的结构可以得出,1mol丁二酮肟中含有15mol的σ键;其中碳原子存在sp2杂化和sp3杂化两种杂化方式;
(3)丁二酮肟镍是由两个丁二酮肟和一个镍构成,丁二酮肟镍中Ni与N原子之间以配位键形式存在,一个丁二酮肟中的O原子与另外一个丁二酮肟中的H原子以氢键形式存在,故答案为ac;
(4)Ni在晶胞中占有8个定点,故一个晶胞中含有![]() =1和Ni原子,Cu在晶胞中占有6个面心,故一个晶胞中含有
=1和Ni原子,Cu在晶胞中占有6个面心,故一个晶胞中含有![]() =3个Cu原子,故镍白铜的分子式为Cu3Ni。
=3个Cu原子,故镍白铜的分子式为Cu3Ni。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:

回答下列问题:
(1)反应I中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为____。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:____。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过____、____、_____(填基本操作)即可回收________(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响。设计如下实验:
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 100 | 2 | 3:1 |
实验②和④的实验目的是___,实验③中反应物物质的量配比为___。反应I中TiO2+浓度对TiO2的产率和粒径的影响如图:

结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为_______。
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景。
(1)可用Pt/Al2O3、Pd/C、Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2(g)+CO(g)CH3OH(g) ΔH<0
①如表所列数据是各化学键的键能,该反应的ΔH=______(用含字母的代数式表示)。
化学键 | H-H | C≡O | C-H | C-O | O-H |
键能/(kJ/mol) | a | b | c | d | e |
②在一定条件下,将1 molCO和2 molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
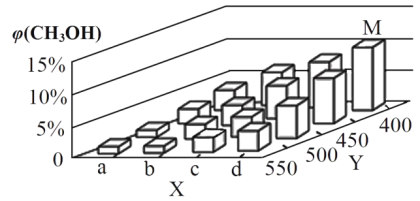
X轴上a点的数值比b点_________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______________。
(2)用CO2和H2合成甲醇:3H2(g) + CO2(g)CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 | |
起始反应物投入量 | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
平衡数据 | c(CH3OH)/molL-1 | c1 | c2 | c3 |
反应的能量变化/kJ | x | y | z | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
①甲容器20s达到平衡时测得x=29.4,则甲中平均反应速率v(CO2)=______。
②下列说法错误的是________(填字母编号)。
A.2c2<c3 B.z>2y C.p3<2p1 D.α1+α3=1
(3)甲醇与水蒸气重整可以制氢。已知:
甲醇分解反应:CH3OH(g)CO(g) + 2H2(g) ΔH1=+90.64 kJ·mol-1
水蒸气变换反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.20 kJ·mol-1
①科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最大的反应方程式为______________。
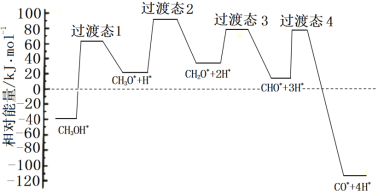
②573.2K时,向一刚性密闭容器中充入5.00MPaCH3OH使其分解,th后达平衡时容器中压强变为10.00MPa,其平衡常数分压Kp =_________。
③在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2 O)=1:1.3的混合气体充入一刚性密闭容器中反应。实验测得水煤气变换反应的速率随温度的升高明显下降,原因是______________。