题目内容
【题目】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
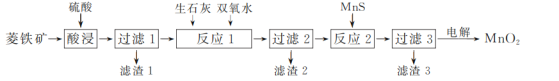
(1)酸浸过程中,MnCO3溶解的离子方程式为______,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________。
(2)滤渣3的主要成分是________,除铁的过程中,应该先加________(填“生石灰”或“双氧水”),原因是__________。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________。
【答案】MnCO3+2H+=Mn2++CO2↑+H2O 若改用盐酸,引入的Cl-在电解过程中产生Cl2,耗费能源且污染环境 Fe2S3和CuS 双氧水 后加CaO,CaO和水反应放热,使双氧水分解 Mn2+-2e-+2H2O=MnO2+4H+
【解析】
向菱锰矿中加入硫酸,矿石中的MnCO3、FeCO3、和少量CuO可以发生反应,进入滤液1中,滤渣1为SiO2;向滤液1中加入生石灰和双氧水,双氧水可以将Fe2+还原为Fe3+,生石灰溶于水发生反应放热,使未完全反应的双氧水分解,同时生成的Ca(OH)2可以中和过量的硫酸,过滤;向滤液2中加入MnS,可使上步没有沉淀的Fe3+和Cu2+转化为Fe2S3和CuS沉淀,滤渣3主要为Fe2S3和CuS,据此回答。
(1)MnCO3为碳酸盐,可以和酸发生反应生成Mn2+、H2O和CO2,离子方程式为MnCO3+2H+=Mn2++CO2↑+H2O;在酸浸过程中应选用硫酸,因为用盐酸的时候,最终产物里含有Cl-在电解的过程中易失去电子生成Cl2,污染环境、浪费能源;
(2)反应2中加入MnS目的是除去体系中少量的Fe3+和Cu2+,发生的相应反应为MnS(s)+Cu2+=Mn2++CuS(s)、3MnS(s)+2Fe3+=Fe2S3(s)+3Mn2+,故滤渣3主要成分为Fe2S3和CuS;除铁过程中应先加入双氧水氧化Fe2+,随后加入CaO,CaO与水反应放热,可以将未参加反应的双氧水分解;
(3)利用惰性电极电解MnCl2制备MnO2,Mn2+失去电子与体系中的水发生反应,电极方程式为Mn2+-2e-+2H2O=MnO2+4H+。

【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
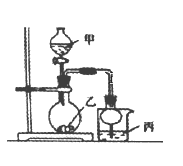
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 淀粉—KI溶液 | 溶液变蓝 |
C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
A.AB.BC.CD.D