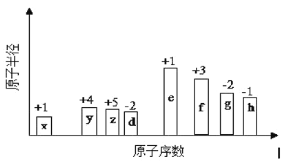
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΩΉ»Η ·ΒΡ÷ς“Σ≥…Ζ÷ΈΣCu2(OH)2CO3Θ§ΜΙΚ§…ΌΝΩΧζΒΡ―θΜ·ΈοΚΆΙηΒΡ―θΜ·ΈοΓΘ“‘œ¬ « Β―ι ““‘ΩΉ»Η ·ΈΣ‘≠Νœ÷Τ±ΗCuSO4ΓΛ5H2OΨßΧεΒΡΝς≥ΧΆΦΘΚ
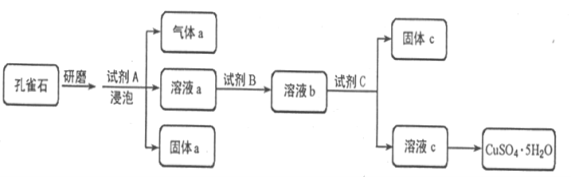
Θ®1Θ©―–ΡΞΩΉ»Η ·ΒΡΡΩΒΡ «________________________________________ΓΘ
Θ®2Θ© Ι”Ο ‘ΦΝBΒΡΡΩΒΡ «ΫΪ»ή“Κ÷–ΒΡFe2ΘΪΉΣΜ·ΈΣFe3ΘΪΘ§ ‘ΦΝBΉν“Υ―Γ”Ο_______Θ®ΧνΉ÷ΡΗΘ©ΓΘ
A Υα–‘KMnO4»ή“Κ B ΥΪ―θΥ° C ≈®œθΥα D –¬÷Τ¬»Υ°
œύ”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «______________ΓΘ
Θ®3Θ© Ι”Ο ‘ΦΝCΒΡΡΩΒΡ «ΒςΫΎ»ή“ΚΒΡpHΘ§ ΙFe3+ΉΣΜ·ΈΣ≥ΝΒμ“‘±ψΖ÷άκΘ§ ‘ΦΝC“Υ―Γ”Ο__________Θ®ΧνΉ÷ΡΗΘ©ΓΘA œΓΝρΥα B NaOH»ή“Κ C Α±Υ° D CuO
Θ®4Θ©≥ΘΈ¬œ¬Fe(OH)3ΒΡKsp = 4ΓΝ10-38Θ§»τ“ΣΫΪ»ή“Κ÷–ΒΡFe3ΘΪΉΣΜ·ΈΣFe(OH)3≥ΝΒμΘ§ΫΪ»ή“ΚΒΡpHΒςΫΎ÷Ν4ΓΘ‘ρ¥Υ ±c(Fe3ΘΪ)=__________ΓΘ
ΓΨ¥πΑΗΓΩ‘ωΦ”ΙΧΧεΫ”¥ΞΟφΜΐΘ§¥”ΕχΦ”ΩλΖ¥”ΠΥΌ¬ B 2Fe2ΘΪΘΪ2HΘΪΘΪH2O2 = 2Fe3ΘΪΘΪ2H2O D 4ΓΝ10-8 molΓΛL-1
ΓΨΫβΈωΓΩ
Θ®1Θ©―–ΡΞΩΉ»Η ·ΒΡΡΩΒΡ «ΈΣΝΥΥα»ήΥΌ¬ ΗϋΩλΘΜ
Θ®2Θ©Α―Fe2+ΉΣΜ·ΈΣFe3+ ”ΠΗΟΦ”»κ―θΜ·ΦΝΘ§«“≤ΜΡή¥χ»κ‘”÷ άκΉ”ΘΜ
Θ®3Θ©ΒςΫΎpH÷Β ΙΧζάκΉ”≥ΝΒμ”Π―Γ”ΟΒΡ ‘ΦΝ≤ΜΡή¥χ»κ‘”÷ άκΉ”ΘΜ
Θ®4Θ©Ksp =c(Fe3+ )ΓΛc3(OH- )= 4ΓΝ10-38Θ§Υυ“‘Α―c(OH- )=1ΓΝ10ΓΣ10 mol/L¥ζ»κΙΪ Ϋ÷–Θ§ΦΤΥψΒΟc(Fe3+ )ΓΘ
Θ®1Θ©―–ΡΞΩΉ»Η ·ΒΡΡΩΒΡ «ΈΣΝΥ‘ω¥σΙΧΧεΫ”¥ΞΟφΜΐΘ§ ΙΥα»ήΥΌ¬ ΗϋΩλΘ§Υυ“‘¥πΑΗΈΣΓΑ‘ω¥σΙΧΧεΫ”¥ΞΟφΜΐΘ§Φ”ΩλΖ¥”ΠΥΌ¬ Γ±ΘΜ
Θ®2Θ©Α―Fe2+ΉΣΜ·ΈΣFe3+ ”ΠΗΟΦ”»κ―θΜ·ΦΝΘ§«“≤ΜΡή¥χ»κ‘”÷ άκΉ”Θ§Υυ“‘”ΟΥΪ―θΥ°Θ§ΥΪ―θΥ°ΒΡΜΙ‘≠≤ζΈο «Υ°Θ§¥πΑΗ―ΓBΓΘœύ”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ2Fe2++2H++H2O2=2Fe3++2H2OΘΜ
Θ®3Θ©“ρΈΣΡΩ±ξ≤ζΤΖ «CuSO4ΓΛ5H2OΨßΧεΘ§ΒςΫΎpH÷Β ΙΧζάκΉ”≥ΝΒμ”Π―Γ”ΟΒΡ ‘ΦΝ≤ΜΡή¥χ»κ‘”÷ άκΉ”Θ§Υυ“‘―Γ”ΟΙΧΧεCuOΘ§¥πΑΗ―ΓDΘΜ
Θ®4Θ©≥ΘΈ¬œ¬ΗυΨίFe(OH)3»ήΫβΤΫΚβFe(OH)3(s) ![]() Fe3+(aq)+3OH- (aq)Ω…ΒΟKsp =c(Fe3+ )ΓΛc3(OH- )= 4ΓΝ10-38Θ§Υυ“‘Α―c(OH- )=1ΓΝ10ΓΣ10 mol/L¥ζ»κΙΪ Ϋ÷–Θ§ΦΤΥψΒΟc(Fe3+ )= 4ΓΝ10-8 molΓΛL-1ΓΘ
Fe3+(aq)+3OH- (aq)Ω…ΒΟKsp =c(Fe3+ )ΓΛc3(OH- )= 4ΓΝ10-38Θ§Υυ“‘Α―c(OH- )=1ΓΝ10ΓΣ10 mol/L¥ζ»κΙΪ Ϋ÷–Θ§ΦΤΥψΒΟc(Fe3+ )= 4ΓΝ10-8 molΓΛL-1ΓΘ

 ’ψ¥σ”≈―ß–Γ―ßΡξΦΕœΈΫ”ΒΦ”κΝΖ’ψΫ≠¥σ―ß≥ωΑφ…γœΒΝ–¥πΑΗ
’ψ¥σ”≈―ß–Γ―ßΡξΦΕœΈΫ”ΒΦ”κΝΖ’ψΫ≠¥σ―ß≥ωΑφ…γœΒΝ–¥πΑΗ –Γ―ß νΦΌΉς“ΒΕΪΡœ¥σ―ß≥ωΑφ…γœΒΝ–¥πΑΗ
–Γ―ß νΦΌΉς“ΒΕΪΡœ¥σ―ß≥ωΑφ…γœΒΝ–¥πΑΗ Ϋρ«≈ΫΧ”ΐ νΦΌΑΈΗΏœΈΫ”ΙψΕΪ»ΥΟώ≥ωΑφ…γœΒΝ–¥πΑΗ
Ϋρ«≈ΫΧ”ΐ νΦΌΑΈΗΏœΈΫ”ΙψΕΪ»ΥΟώ≥ωΑφ…γœΒΝ–¥πΑΗ ≤®≤®–ή νΦΌΉς“ΒΫ≠Ές»ΥΟώ≥ωΑφ…γœΒΝ–¥πΑΗ
≤®≤®–ή νΦΌΉς“ΒΫ≠Ές»ΥΟώ≥ωΑφ…γœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΡ…ΟΉTiO2ΨΏ”– °Ζ÷±ΠΙσΒΡΙβ―ß–‘÷ Θ§‘ΎΤϊ≥ΒΙΛ“ΒΦΑ÷νΕύΝλ”ρΕΦœ‘ Ψ≥ωΟάΚΟΒΡΖΔ’Ι«ΑΨΑΓΘœ¬ΆΦ «“‘ΝρΥα―θν―ΈΣ‘≠Νœ÷Τ±ΗΡ…ΟΉΕΰ―θΜ·ν―ΒΡΙΛ“’Νς≥ΧΆΦΘΚ

ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©Ζ¥”ΠI÷–ΖΔ…ζΝΫΗωΖ¥”ΠΘ§Τδ“Μ «ΡρΥΊ[CO(NH2)2]”κH2OΖ¥”Π…ζ≥…CO2ΚΆNH3ΓΛH2OΘ§‘ρΝμ“ΜΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ____ΓΘ
Θ®2Θ©≈–ΕœTiO(OH)2≥ΝΒμ «Ζώœ¥ΨΜΒΡ Β―ι≤ΌΉςΚΆœ÷œσ «ΘΚ____ΓΘ
Θ®3Θ©ΈΣΝΥΦθ…Ό÷Τ±ΗΙΐ≥Χ÷–ΒΡΓΑ»ΐΖœΓ±≈≈Ζ≈Θ§ΫΪ…œ ωΝς≥Χ÷–ΒΡΓΑ¬Υ“ΚΓ±Ψ≠Ιΐ____ΓΔ____ΓΔ_____Θ®ΧνΜυ±Ψ≤ΌΉςΘ©Φ¥Ω…ΜΊ ’________Θ®ΧνΜ·―ß ΫΘ©ΓΘ
Θ®4Θ©ΈΣ―–ΨΩΖ¥”ΠΈ¬Ε»ΓΔΖ¥”Π ±ΦδΓΔΖ¥”ΠΈοΈο÷ ΒΡΝΩ≈δ±»Β»“ρΥΊΕ‘÷Τ±ΗΡ…ΟΉΕΰ―θΜ·ν―≤ζ¬ ΒΡ”ΑœλΓΘ…ηΦΤ»γœ¬ Β―ιΘΚ
Β―ι±ύΚ≈ | Ζ¥”ΠΈ¬Ε»/Γφ | Ζ¥”Π ±Φδ/h | Ζ¥”ΠΈοΈο÷ ΒΡΝΩ≈δ±» |
ΔΌ | 90 | 1 | 2:1 |
ΔΎ | 90 | 2 | 3:1 |
Δέ | 90 | 1 | |
Δή | 100 | 2 | 3:1 |
Β―ιΔΎΚΆΔήΒΡ Β―ιΡΩΒΡ «___Θ§ Β―ιΔέ÷–Ζ¥”ΠΈοΈο÷ ΒΡΝΩ≈δ±»ΈΣ___ΓΘΖ¥”ΠI÷–TiO2+≈®Ε»Ε‘TiO2ΒΡ≤ζ¬ ΚΆΝΘΨΕΒΡ”Αœλ»γΆΦΘΚ

ΫαΚœΆΦ÷––≈œΔΘ§Ρψ»œΈΣΈΣ¥οΒΫΙΛ“’ΡΩΒΡΘ§ΉνΚœ ΒΡTiO2+≈®Ε»ΈΣ_______ΓΘ
ΓΨΧβΡΩΓΩΦΉ¥Φ «“Μ÷÷Ω…‘Ό…ζΡή‘¥Θ§ΨΏ”–ΙψάΪΒΡΩΣΖΔΚΆ”Π”Ο«ΑΨΑΓΘ
Θ®1Θ©Ω…”ΟPt/Al2O3ΓΔPd/CΓΔRh/SiO2Β»Ής¥ΏΜ·ΦΝΘ§≤…”Ο»γœ¬Ζ¥”Πά¥Κœ≥…ΦΉ¥ΦΘΚ2H2(g)+CO(g)CH3OH(g) ΠΛH<0
ΔΌ»γ±μΥυΝ– ΐΨί «ΗςΜ·―ßΦϋΒΡΦϋΡήΘ§ΗΟΖ¥”ΠΒΡΠΛH=______Θ®”ΟΚ§Ή÷ΡΗΒΡ¥ζ ΐ Ϋ±μ ΨΘ©ΓΘ
Μ·―ßΦϋ | H-H | CΓ‘O | C-H | C-O | O-H |
ΦϋΡή/(kJ/mol) | a | b | c | d | e |
ΔΎ‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§ΫΪ1 molCOΚΆ2 molH2Ά®»κΟή±’»ίΤς÷–Ϋχ––Ζ¥”ΠΘ§Β±ΗΡ±δΡ≥“ΜΆβΫγΧθΦΰΘ®Έ¬Ε»Μρ―Ι«ΩΘ© ±Θ§CH3OHΒΡΧεΜΐΖ÷ ΐΠ’(CH3OH)±δΜ·«ς Τ»γΆΦΥυ ΨΘΚ
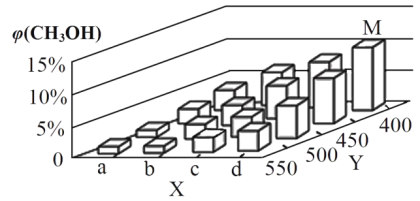
X÷α…œaΒψΒΡ ΐ÷Β±»bΒψ_________Θ®ΧνΓΑ¥σΓ±ΜρΓΑ–ΓΓ±Θ©ΓΘΡ≥Ά§―ß»œΈΣ…œΆΦ÷–Y÷α±μ ΨΈ¬Ε»Θ§Ρψ»œΈΣΥϊ≈–ΕœΒΡάμ”… «_______________ΓΘ
Θ®2Θ©”ΟCO2ΚΆH2Κœ≥…ΦΉ¥ΦΘΚ3H2(g) + CO2(g)CH3OH(g) + H2O(g) ΓςH=Θ≠49.0kJΓΛmolΘ≠1ΓΘ‘ΎTΓφ ±Θ§ΦΉΓΔ““ΓΔ±ϊ»ΐΗω2LΒΡΚψ»ίΟή±’»ίΤς÷–Θ§Α¥≤ΜΆ§ΖΫ ΫΆΕ»κΖ¥”ΠΈοΘ§≤βΒΟΤΫΚβ ±”–ΙΊ ΐΨί»γœ¬ΘΚ
»ίΤς | ΦΉ | ““ | ±ϊ | |
Τπ ΦΖ¥”ΠΈοΆΕ»κΝΩ | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
ΤΫΚβ ΐΨί | c(CH3OH)/molL-1 | c1 | c2 | c3 |
Ζ¥”ΠΒΡΡήΝΩ±δΜ·/kJ | x | y | z | |
ΧεœΒ―Ι«Ω/Pa | p1 | p2 | p3 | |
Ζ¥”ΠΈοΉΣΜ·¬ | ΠΝ1 | ΠΝ2 | ΠΝ3 | |
ΔΌΦΉ»ίΤς20s¥οΒΫΤΫΚβ ±≤βΒΟx=29.4Θ§‘ρΦΉ÷–ΤΫΨυΖ¥”ΠΥΌ¬ v(CO2)=______ΓΘ
ΔΎœ¬Ν–ΥΒΖ®¥μΈσΒΡ «________Θ®ΧνΉ÷ΡΗ±ύΚ≈Θ©ΓΘ
AΘ°2c2<c3 BΘ°z>2y CΘ°p3<2p1 DΘ°ΠΝ1+ΠΝ3=1
Θ®3Θ©ΦΉ¥Φ”κΥ°’τΤχ÷Ί’ϊΩ…“‘÷Τ«βΓΘ“―÷ΣΘΚ
ΦΉ¥ΦΖ÷ΫβΖ¥”ΠΘΚCH3OH(g)CO(g) + 2H2(g) ΠΛH1=+90.64 kJΓΛmolΘ≠1
Υ°’τΤχ±δΜΜΖ¥”ΠΘΚCO(g)+H2O(g)CO2(g)+H2(g) ΠΛH2=Θ≠41.20 kJΓΛmolΘ≠1
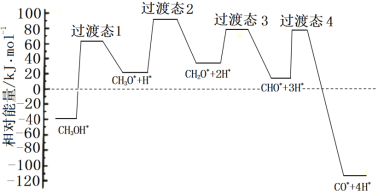
ΔΌΩΤ―ßΦ“Ά®ΙΐΟήΕ»ΖΚΚ·άμ¬έ―–ΨΩΦΉ¥Φ”κΥ°’τΤχ÷Ί’ϊ÷Τ«βΖ¥”ΠΜζάμ ±Θ§ΒΟΒΫΦΉ¥Φ‘ΎPd(Δσ)±μΟφΖΔ…ζΫβάκ ±ΥΡΗω¬ΖΨΕ”κœύΕ‘ΡήΝΩΙΊœΒ»γΆΦΥυ ΨΘ§Τδ÷–ΗΫ‘ΎPd(Δσ)±μΟφΒΡΈο÷÷”Ο*±ξΉΔΓΘ¥Υάζ≥Χ÷–ΜνΜ·ΡήΉν¥σΒΡΖ¥”ΠΖΫ≥Χ ΫΈΣ______________ΓΘ
ΔΎ573.2K ±Θ§œρ“ΜΗ’–‘Οή±’»ίΤς÷–≥δ»κ5.00MPaCH3OH ΙΤδΖ÷ΫβΘ§thΚσ¥οΤΫΚβ ±»ίΤς÷–―Ι«Ω±δΈΣ10.00MPaΘ§ΤδΤΫΚβ≥Θ ΐΖ÷―ΙKp =_________ΓΘ
Δέ‘Ύ0.1MPaœ¬Θ§ΫΪΉήΫχΝœΝΩ1mol«“n(CH3OH):n(H2 O)=1:1.3ΒΡΜλΚœΤχΧε≥δ»κ“ΜΗ’–‘Οή±’»ίΤς÷–Ζ¥”ΠΓΘ Β―ι≤βΒΟΥ°ΟΚΤχ±δΜΜΖ¥”ΠΒΡΥΌ¬ ΥφΈ¬Ε»ΒΡ…ΐΗΏΟςœ‘œ¬ΫΒΘ§‘≠“ρ «______________ΓΘ