题目内容
6.在500mL醋酸溶液中,溶有醋酸3.00g,其中Ac-3.92×10-2g,求此溶液中醋酸的电离度.分析 先计算醋酸溶液的物质的量浓度,再据醋酸根离子浓度解和电离度α=$\frac{已电离醋酸浓度}{溶液中醋酸总浓度}$×100%计算.
解答 解:c(HAc)=$\frac{\frac{3.00g}{60g/mol}}{0.5L}$=0.1mol/L,c(Ac-)=c(H+)=$\frac{\frac{0.0392g}{59g/mol}}{0.5L}$=0.0013mol/L,所以醋酸的电离度α=$\frac{已电离醋酸浓度}{溶液中醋酸总浓度}$×100%=$\frac{0.0013}{0.1}$×100%=1.3%,
答:此溶液中醋酸的电离度为1.3%.
点评 本题考查了电离度的计算,关键是质量与物质的量的换算,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
16.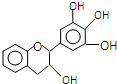 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 该有机物的分子式是C15H13O5 | |
| B. | 1mol EGC与4molNa生成气体体积为44.8L | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 分子中所有的原子共面 |
17. 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 图中的b>a | |
| D. | 该过程中的产品还有H2SO4 |
14.下列说法正确的是( )
| A. | 能使甲基橙显红色的溶液中大量存在:Mg2+、Na+、Cl-、F- | |
| B. | 标准状况下,46gNO2和N2O4混合气体中含有原子个数为3NA | |
| C. | 1L0.5mol•L-1 CuSO4溶液中含有0.5NA个Cu2+ | |
| D. | 浓度均为0.1 mol/L的氨水和盐酸、由水电离出的c(H+):盐酸>氨水 |
1.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 0.2mol•L-1 Na2SO4溶液中含有0.4NA个Na | |
| B. | 在标准状况下,NA个C02分子与NA个H2SO4分子所占的体积之比为1:1 | |
| C. | 5.6g铁在足量氯气中燃烧时失去的电子数目为0.2NA | |
| D. | 常温常压下,64g SO2中含有的原子数为3NA |
11.下列分子式表示的有机物的同分异构体共有四种的是(不考虑立体异构)( )
| A. | C3H7Cl | B. | C3H6Cl2 | C. | C3H5Cl3 | D. | C3HCl7 |
3.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5;④1s22s22p63s23p2则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>④>① | B. | 原子半径:①>②>④>③ | ||
| C. | 电负性:③>①>②>④ | D. | 最高正化合价:③>①>②>④ |
20.在正规考试化学试卷的试题前总有“可能用到的相对原子质量”一项,如H-1 C-12 Cl-35.5 N-14等.请问这些数据准确的说法应该是( )
| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的质量数 | |
| C. | 某种元素所有核素质量数的平均值 | |
| D. | 某种元素的平均相对原子质量的近似值 |