题目内容
13. 某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.
某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.(1)由此判断NaOH溶液跟盐酸的反应是放热(填“吸热”或“放热”下同)反应,Ba(OH)2•8H2O跟NH4Cl的反应是吸热;
(2)试从反应物与生成物所含能量分析②反应的结论反应物总能量小于生成物总能量.
分析 (1)根据温度升高,反应放热,温度降低、反应吸热;
(2)根据反应物总能量大于生成物总能量为放热反应,反应物总能量小于生成物总能量为吸热反应分析.
解答 解:(1)因温度升高,反应放热,温度降低、反应吸热,所以NaOH溶液跟盐酸的反应是放热反应,Ba(OH)2•8H2O跟NH4Cl的反应是吸热反应,故答案为:放热;吸热;
(2)因为 Ba(OH)2•8H2O跟NH4Cl的反应是吸热反应,属于反应物总能量小于生成物总能量,故答案为:反应物总能量小于生成物总能量.
点评 本题考查了根据实验现象判断放热与吸热反应,注意反应物总能量大于生成物总能量为放热反应,反应物总能量小于生成物总能量为吸热反应,难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
3.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5;④1s22s22p63s23p2则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>④>① | B. | 原子半径:①>②>④>③ | ||
| C. | 电负性:③>①>②>④ | D. | 最高正化合价:③>①>②>④ |
4.下列有机物在常温下呈液态的是( )
| A. | CH3(CH2)4CH3 | B. | C18H38 | C. | C3H6 | D. | CH3Cl |
18.在含有大量的Na+、OH-、NO3-,该溶液中还可能大量存在的离子是( )
| A. | NH4+ | B. | H+ | C. | SO42- | D. | Mg2+ |
5.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
由上述现象可推知a、b、c、d依次是( )
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | AgNO3、HCl、Na2CO3、BaCl2 | B. | AgNO3、HCl、BaCl2、Na2CO3 | ||
| C. | BaCl2、Na2CO3、AgNO3、HCl | D. | HCl、BaCl2、AgNO3、Na2CO3 |
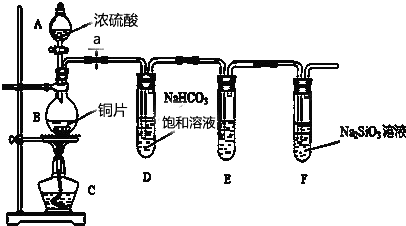
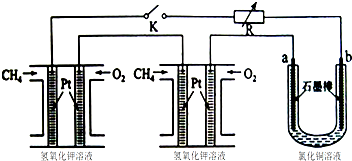


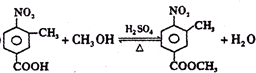 ,使用过量CH3OH的作用是提高D的产率.
,使用过量CH3OH的作用是提高D的产率.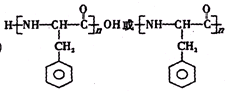 .
.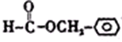 .
.