题目内容
10.已知0.1mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mol/L,请回答下列问题:(1)写出NaHSO4在水溶液中的电离方程式NaHSO4═Na++H++SO42-.
(2)NaHSO4属于盐类,你的理由是NaHSO4在水溶液中电离出金属阳离子和酸根离子.
(3)①若将NaHSO4与Ba(OH)2在溶液中按物质的量比1:1混合,发生反应的离子方程式是:H++SO42-+OH-+Ba2+=BaSO4↓+H2O
②向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-沉淀完全,发生反应的离子方程式是:H++SO42-+OH-+Ba2+=BaSO4↓+H2O.
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,发生反应的离子方程式是:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O.
分析 (1)强电解质完全电离,用“=”,硫酸氢根离子是强酸对应的酸式酸根离子应拆分;
(2)金属离子和酸根离子形成的化合物属于盐;
(3)①NaHSO4与Ba(OH)2在溶液中按物质的量之比1:1混合时生成硫酸钡和水的物质的量之比为1:1;
②硫酸根离子完全沉淀时,硫酸氢钠与氢氧化钡的物质的量相等;
③NaHSO4与Ba(OH)2在溶液中按物质的量之比2:1混合时,氢离子与氢氧根离子恰好反应,溶液为中性.
解答 解:(1)NaHSO4是强电解质,在溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-;
(2)因NaHSO4是由钠离子和硫酸氢根离子构成,则硫酸氢钠属于盐,
故答案为:NaHSO4在水溶液中电离出金属阳离子和酸根离子;
(3)①NaHSO4与Ba(OH)2在溶液中按物质的量之比1:1混合时,钡离子与硫酸根离子恰好反应,反应的离子方程式为:H++SO42-+OH-+Ba2=BaSO4↓+H2O,
故答案为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;
②SO42-沉淀完全时,NaHSO4与Ba(OH)2在溶液中按物质的量之比1:1,反应的离子方程式为:H++SO42-+OH-+Ba2=BaSO4↓+H2O,
故答案为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;
③NaHSO4与Ba(OH)2在溶液中按物质的量之比2:1混合,溶液为中性,其反应的离子方程式为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O,
故答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O.
点评 本题考查电离方程式和离子方程式的书写,题目难度中等,明确电解质的强弱及离子反应中物质的量的关系是解答的关键,试题培养了学生的分析能力及灵活应用基础知识的能力.

| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的质量数 | |
| C. | 某种元素所有核素质量数的平均值 | |
| D. | 某种元素的平均相对原子质量的近似值 |
| A. | NH4+ | B. | H+ | C. | SO42- | D. | Mg2+ |
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | AgNO3、HCl、Na2CO3、BaCl2 | B. | AgNO3、HCl、BaCl2、Na2CO3 | ||
| C. | BaCl2、Na2CO3、AgNO3、HCl | D. | HCl、BaCl2、AgNO3、Na2CO3 |
| A. | 废旧轮胎均可直接在室外焚烧处理 | |
| B. | 电木可溶于酒精 | |
| C. | 聚氯乙烯属于吸水性高分子树脂 | |
| D. | 复合材料玻璃钢具有强度高、质量轻等优点 |
| A. | H2和D2互为同位素 | B. |  和 和  互为同分异构体 互为同分异构体 | ||
| C. | H、D、T互称为同素异形体 | D. |  和 和 是同一种物质 是同一种物质 |
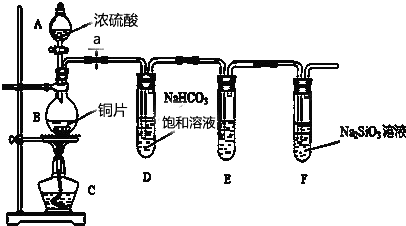


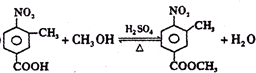 ,使用过量CH3OH的作用是提高D的产率.
,使用过量CH3OH的作用是提高D的产率.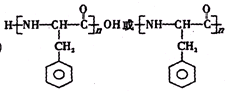 .
.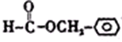 .
.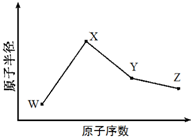 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.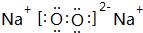 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式). .
.