题目内容
2.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如图:
(1)废渣a、b 的成分分别是二氧化硅、氢氧化铁(写名称).
(2)流程图中X的化学式为H2SO4.
(3)反应Ⅲ的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)蒸发浓缩、冷却结晶、过滤、洗涤.
(4)反应Ⅶ的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2;NH4HSO4溶液中离子浓度由大到小顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-).
分析 铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)铝土矿的主要成分是氧化铝,根据题中流程图可知,在反应Ⅲ中通入二氧化碳,而流程最后要得到硫酸盐,所以为了除去杂质,先在铝土矿中加入过量的稀硫酸,得废渣a为SiO2,滤液中含有Al3+、Fe3+,所以X为稀硫酸,再加过量的氢氧化钠溶液,生成偏铝酸钠溶液和氢氧化铁沉淀,所以废渣b为氢氧化铁,Y为氢氧化钠,反应Ⅲ为偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和废液,反应Ⅳ为氢氧化铝中加上硫酸可以制得Al2(SO4)3,反应Ⅵ中氨气与硫酸反应生成(NH4)2SO4,反应Ⅴ中(NH4)2SO4转化为铵明矾,电解硫酸和硫酸铵的混合溶液,在阴极上得氢气,阳极上得(NH4)2S2O8,反应ⅤⅡ为(NH4)2S2O8与水反应生成双氧水和NH4HSO4,据此答题.
解答 解:铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)铝土矿的主要成分是氧化铝,根据题中流程图可知,在反应Ⅲ中通入二氧化碳,而流程最后要得到硫酸盐,所以为了除去杂质,先在铝土矿中加入过量的稀硫酸,得废渣a为SiO2,滤液中含有Al3+、Fe3+,所以X为稀硫酸,再加过量的氢氧化钠溶液,生成偏铝酸钠溶液和氢氧化铁沉淀,所以废渣b为氢氧化铁,Y为氢氧化钠,反应Ⅲ为偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和废液,反应Ⅳ为氢氧化铝中加上硫酸可以制得Al2(SO4)3,反应Ⅵ中氨气与硫酸反应生成(NH4)2SO4,反应Ⅴ中(NH4)2SO4转化为铵明矾,电解硫酸和硫酸铵的混合溶液,在阴极上得氢气,阳极上得(NH4)2S2O8,反应ⅤⅡ为(NH4)2S2O8与水反应生成双氧水和NH4HSO4,
(1)根据上面的分析可知,废渣a为SiO2,名称为二氧化硅,废渣b为氢氧化铁,
故答案为:二氧化硅;氢氧化铁;
(2)根据上面的分析可知,流程图中X为稀硫酸,X的化学式为H2SO4,
故答案为:H2SO4;
(3)反应Ⅲ为偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应Ⅲ的离子方程式为 AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,铵明矾晶体中有结晶水,温度过高会使结晶水失去,所以从铵明矾溶液中获得铵明矾晶体的操作依次为 蒸发浓缩、冷却结晶、过滤、洗涤,
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;蒸发浓缩;
(4)根据元素守恒和题中信息可知,反应Ⅶ的化学方程式为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2,NH4HSO4溶液中电离出SO42-、H+、NH4+,其中铵根离子水解生成氢离子,所以溶液中离子浓度由大到小顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-),
故答案为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2;c(H+)>c(SO42-)>c(NH4+)>c(OH-).
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、方程式书写、电解原理的应用等,难度中等,需要学生具备阅读获取信息能力、综合运用知识、信息分析问题解决问题能力.

| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H1 H2(g)+Cl2(g)═2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| D. | S(g)+O2(g)═SO2(g);△H1 S(s)+O2(g)═SO2(g);△H2 |
| A. | 溶液中一定存在Na+、I-、CO32- | |
| B. | 溶液中一定不存在的只有I-、SO32- | |
| C. | 只需再进行一个实验,就可完全确定溶液的组成 | |
| D. | 溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
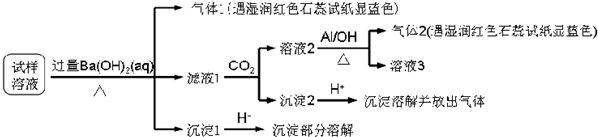
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 试样中可能存在Na+、Cl- | |
| C. | 试样中一定不含Al3+ | |
| D. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
| A. | 固体烧碱要密封存放 | |
| B. | 常时间放置的澄清石灰水变浑浊 | |
| C. | 浓硫酸露置于空气中会增重、变稀 | |
| D. | 铜制品长期放在空气中会产生“铜锈” |

| A. | 加水稀释(假设温度都不变)时,M、N点均不动 | |
| B. | 都降温10℃后,M点沿曲线向左下移,N点向左平移 | |
| C. | 都升温10℃后,M、N点均向右平移 | |
| D. | 蒸发溶剂(假设温度都不变)时,先是M点不动,N点向上移至曲线;继续蒸发溶剂,M、N点都不动 |
 如图装置中,a、b都是惰性电极,A、B装置中的溶液均是足量的,通电一段时间后,B装置中b极附近溶液呈红色.
如图装置中,a、b都是惰性电极,A、B装置中的溶液均是足量的,通电一段时间后,B装置中b极附近溶液呈红色.