题目内容
1.用坩埚钳夹住一小块刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝箔不滴落.下列关于上述实验中有关问题的解释不正确的是( )| A. | 铝在空气中能很快形成氧化膜 | |
| B. | 铝箔失去金属光泽,氧化铝包裹着金属铝 | |
| C. | 氧化铝的熔点比铝高 | |
| D. | 氧化铝与盐酸不反应 |
分析 铝在加热时易与氧气反应生成氧化铝,氧化铝的熔点高,氧化铝包裹在Al的外面,以此来解答.
解答 解:用盐酸处理过的铝箱,在酒精灯上加热至熔化,发现熔化的铝并不滴落,可观察到铝箔熔化,失去金属光泽,铝在空气中能很快形成氧化膜,熔化的铝并不滴落,是因氧化铝的熔点高,氧化铝包裹在Al的外面,
只有选项D不合理,氧化铝与盐酸可反应生成氯化铝和水,且与该实验无关,
故选D.
点评 本题考查Al及氧化铝的性质,为高频考点,把握物质的性质及发生的反应为解答的关键,注意氧化铝的熔点,注重基础知识的考查,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
12.同温同压下,下列各组热化学方程式中,△H1<△H2 的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H1 H2(g)+Cl2(g)═2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| D. | S(g)+O2(g)═SO2(g);△H1 S(s)+O2(g)═SO2(g);△H2 |
6.在(NH4)2Fe(SO4)2溶液中逐滴加入100mL 1mol/L的Ba(OH)2溶液,把所得沉淀过滤、洗涤、干燥,得到的固体质量不可能是( )
| A. | 35.3g | B. | 33.5g | C. | 32.3g | D. | 11.3g |
13.某溶液中可能含有Na+、I-、CO32-、SO32-、Br-、NH4+、Ba2+.某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化.下列说法正确的是( )
| A. | 溶液中一定存在Na+、I-、CO32- | |
| B. | 溶液中一定不存在的只有I-、SO32- | |
| C. | 只需再进行一个实验,就可完全确定溶液的组成 | |
| D. | 溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
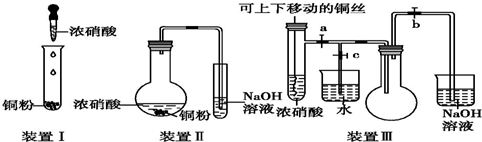
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.图2是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.图2是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: 如图装置中,a、b都是惰性电极,A、B装置中的溶液均是足量的,通电一段时间后,B装置中b极附近溶液呈红色.
如图装置中,a、b都是惰性电极,A、B装置中的溶液均是足量的,通电一段时间后,B装置中b极附近溶液呈红色.