题目内容
12.短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )| A. | 质子数:C>d | B. | 离子还原性:Y>Z | C. | 稳定性:H2Y>HZ | D. | 原子半径:X<W |
分析 短周期元素离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子序数a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,
A.由以上分析可知,质子数d>c,故A错误;
B.非金属性Y<Z,元素的非金属性越强,对应的阴离子的还原性越弱,故B正确;
C.非金属性Y<Z,元素的非金属性越强,氢化物越稳定,故C错误;
D.同周期随原子序数增大,原子半径减小,故原子半径Na>Al,故D错误.
故选B.
点评 本题考查结构位置性质关系应用,侧重对元素周期律的考查,可以确定元素的相对位置结合元素周期律解答,难度不大.

练习册系列答案
相关题目
3.相距很远的两个氢原子相互逐渐靠近,在这一过程中体系能量将( )
| A. | 逐渐变小 | B. | 逐渐增大 | C. | 先变大,后变小 | D. | 先变小,后变大 |
20.SO2和Cl2均是常用的漂白剂,若将SO2和Cl2等物质的量混合后,先缓慢通入到BaCl2溶液中,再滴入品红试液,会观察到的现象是( )
| A. | 无沉淀生成,溶液显红色 | B. | 无沉淀生成,溶液显无色 | ||
| C. | 有沉淀生成,溶液显无色 | D. | 有沉淀生成,溶液显红色 |
1.下列关于有机物的说法正确的是( )
| A. | 羟基的电子式: | B. | 丙烷的球棍模型为: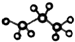 | ||
| C. |  和 和 互为同系物 互为同系物 | D. | 邻羟基苯甲酸的结构简式: |
2.有机物分子式为C5H11Cl,其可能的结构有多少种( )
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
 .
.
 .
. .
. 分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题: